EFECTOS GLOBALES DE LA CONTAMINACIÓN ATMOSFÉRICA
DESTRUCCION DE LA CAPA DE OZONO
(efecto de los contaminantes atmosféricos sobre la estratosfera)
El nivel de ozono sobre la superficie terrestre es tóxico y está producido por una serie de procesos como los tubos de escape de los vehículos o cuando los HC se combinan a la luz del sol con el NO2.
Sin embargo la delgada capa de O3 que existe en la estratosfera es fundamental para la vida en la Tierra.
Molécula de ozono (O3)
Recordemos que se produce como consecuencia de la disociación del O2 por la radiación ultravioleta. A a su vez, el ozono recien formado es rapidamente destruido por la radiación UV originándose O atómico que se recombina nuevamente para formar ozono por lo que este proceso no es perdida y su unico resultado es la total absorción en la estratosfera de la radiación ultravioleta comprendida entre 200 y 310 nm, protegiendo así la vida en la tierra.
Reacciones de formación y destrucción del ozono
(visto en funciones de la atmósfera)
1º Fotólisis del oxígeno O2 + UV -------- O + O
2º Formación del ozono O+ O2 -------- O3 + Calor
3º Destrucción natural del ozono
a) fotólisis del ozono
O3 + UV ------- O2 + O
b) posible reacción con el O atómico:
O + O3 ----- O2 + O2
En condiciones normales estas reacciones están en un equilibrio dinámico, y además de retener el 90-95% de los UV, producen un incremento en la temperatura de la estratosfera, debido a la liberación de calor.
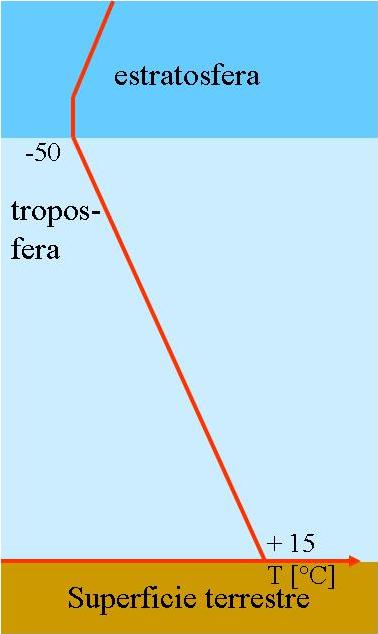
La estratosfera se halla a una altitud de entre 15 y 50 Km, con una concentración máxima en ozono a los 20 Km por encima de la superficie de la tierra. Aún así, está tan diluida que su concentración no excede de las 10 ppm. Si descendiera a nivel del mar, la presión la comprimiría hasta formar una capa de unos 3 mm de espesor. Las cantidades de ozono estratosférico sufren variaciones diarias y estacionales en función de la radiación solar
Un poco de historia...Entre 1977 y 1984 se detectó que la cantidad de ozono presente durante la primavera en la Antártida (meses de septiembre y octubre) disminuía un 70% para volver a recuperarse tras el final del verano austral. Los científicos denominaron a este fenómeno "el agujero de ozono".
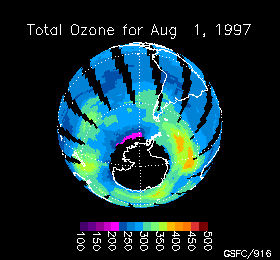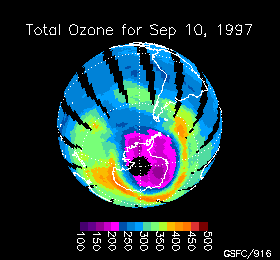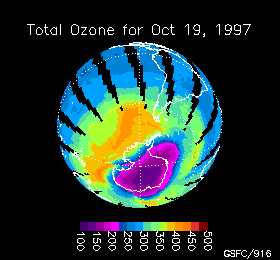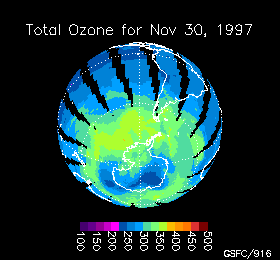
Variación de la concentración de ozono en la Antártida durante 1997
Pero de forma paralela se detectó un deterioro progresivo, año tras año, de la capa de ozono, desde 1980, inicialmente en la Antártida, posteriormente en el Ártico y en menor medida en latitudes medias. Los valores de concentración de ozono disminuyeron progresivamente hasta mediados de los noventa del siglo pasado.
La cantidad de ozono se mide en unidades Dobson y con un instrumento llamado TOMS (Total Ozone Mapping Spectrometer = espectrómetro de seguimiento total de ozono) que determina la cantidad de ozono en una columna de 50 Km, desde el techo de la estratosfera hasta el suelo, haciendo un barrido hasta cubrir todo el planeta. Los datos son procesados por ordenadores y transformados en imagenes que muestran mapas codificados en color cuya escala varía entre las altas concentraciones de ozono (color rojo) y las bajas concentraciones (color violeta) llegando hasta el negro.
Tras establecer científicamente la relación causa efecto existente entre agentes destructores de ozono y la concentración atmosférica de esta molécula (ver descubridores) y entre la evolución de dicha concentración y los posibles efectos negativos sobre la salud humana y los ecosistemas, se llegó en poco tiempo un acuerdo internacional plasmado en el Protocolo de Montreal (que data de 1987 y cuyas propuestas fueron aceleradas en las enmiendas realizadas en las dos sucesivas revisiones (Londres, 1990 y Copenhague, 1992) en los que se acordaron recortes o ceses de producción de CFCs en unos plazos determinados. La segunda de estas reuniones (Reunión de Copenhagen) acotó aun más los plazos: los CFCs halogenados totalmente junto con los halones y el bromuro de metilo fueron eliminados el 1 de enero de 1996 y los HCFCs comenzaron a congelarse a partir de 1996.
Compuestos químicos responsables
Los NOxEn los años 70 se culpo del aumento de estos compuestos a los aviones que volaban por la estratosfera, liberando ingentes cantidades de ellos, ya que los NOx (NO2 y NO) emitidos a la troposfera no podían alcanzar la estratosfera ya que se trata de compuestos sumamente reactivos al nivel de la troposfera (recordar el ciclo fotolítico del nitrógeno).
Sin embargo el N2O (óxido nitroso) que se produce junto con los NOx en las combustiones, el procedente de la desnitrificación de los suelos agrícolas (incrementada por el uso excesivo de abonos nitrogenados) y el que se produce en las tormentas (sobre todo tropicales) es un compuesto poco reactivo que puede ascender hasta la estratosfera donde se transforma en NOx mediante un proceso de fotólisis.
Una vez allí, los NOx reaccionan con el ozono del siguiente modo:
NO + O3 -------- NO2 + O2
NO2 + O -------- NO + O2
________________________O3 + O ---------- O2 + O2 (balance de ambas) (1)
Como podemos obsservar, los NOx estratosféricos en principio participarían como catalizadores (no se consumen) en la reacción de destrucción del ozono, pudiendo repetirse una y otra vez.Si estas reacciones fueran las unicas existentes supondrían una rebaja en los niveles de O3; pero esto no es así, ya que los NO2 pueden reaccionar de otras múltiples maneras, entre ellas con grupos OH- para formar HNO3.
Los compuestos de cloro
Como ejemplo de compuestos de origen natural que contienen Cl podemos citar el NaCl y el HCl que son liberados por el mar y en las erupciones vocánicas.
Dentro de los de origen antrópico se encuentran los compuestos clorofluorocarbonados (CFCs) utilizados como propelentes de sprays, en disolventes y refrigerantes y que son una familia de compuestos orgánicos sintéticos derivados del metano o del etano, en los que los átomos de hidrógeno han sido sustituidos por átomos de flúor, cloro y/o bromo, lo cual aporta una enorme estabilidad a la molécula.son moléculas. No son tóxicos, son inodoros y no inflamables (ver contaminantes primarios)
CFC-11 (CCl3F)
Trichlorofluorometano
Mario Molina y Sherwood Rowland fueron los primeros científicos en advertir de la creciente amenaza que el uso de los gases CFCs suponían para la capa de ozono. El hecho de que fueran tan poco reactivos, les permitía permanecer invariables durante el tiempo suficiente como para ascender lentamente hacia la estratosfera.
Cuando una molécula de CFCs se ve expuesta a la radiacion UV, se rompe, liberando un atomo de cloro que ataca al O3 y le arranca un atomo de O. Aparece entonces un atomo de O libre que se lleva el atomo de O perteneciente al monóxido de cloro Esto deja de nuevo solo al cloro que repite el proceso y descompone otra moleciula de ozono. De este modo un atomo de cloro puede destruir entre 20.000 y 100.000 moléculas de O3. De la siguiente forma:
· Fotolisis de los CFCs:
CFCCl3 + UV ----------CFCCl2 + Cl
· Destrucción del ozono:
Cl + O3 -------------- "ClO" + O2
"ClO" + O ------------ Cl + O2
__________________________Balance: O3 + O --------- O2 + O2 (2)
Este proceso que puede durar 100 años, ya que cada atomo de cloro es capaz de destruir hasta 100.000 moléculas de ozono (reaccion similar la 1)
Ver animación de todas las reacciones de los CFCs
Sin embargo, existe una tercera reaccion entre la (1) y la (2). Esta reacción es la que pone en cuestión el papel ¿perjudicial o beneficioso? de los NOx
NOx + ClO ------------> ClNO3 (nitrato de cloro)
Mediante esta reacción, al formarse el nitrato de cloro el cloro quedaría secuestrado y de este modo se protegería al ozono de la acción del cloro. De esta manera los NO2 presentes en la estratosfera desempeñan el importantísimo papel de atrapar al cloro produciendo su inactivaciónTambién puede formarse cloruro de hidrógeno -ácido clorhídrico- a partir del metano
ClO + CH4-------------->HCl + CH3+
Tanto el nitrato de cloro como el cloruro de hidrógeno son estables y formarían un depósito de cloro; este secuestro del cloro libre de la atmósfera impediría la reacción disociadora del ozono.
Explicación de la variación estacional de la concentración de ozono en la Antártida
Ya hemos comentado que en septiembre y octubre, es decir, en la primavera austral se produce un descenso del ozono sobre el continente antártico, produciéndose posteriormente una cierta recuperación. Por tanto, el modelo que se ha esquematizado anteriormente debe complementarse con otros procesos que expliquen este comportamiento de la capa de ozono.
Nubes estratosféricas polares
Para entender lo que sucede en la Antártida, hay que señalar que en el invierno antártico, se genera un vórtice polar a partir de vientos de gran velocidad que girarían en círculo en torno al Polo Sur y aislarían la atmósfera, impidiendo el intercambio gaseoso con regiones próximas. Esto, junto con la ausencia de luz solar, ocasionaría temperaturas muy bajas y una circulación vertical del aire que generaría las denominadas nubes estratosféricas polares (NEP) en cuya composición entraría el ácido nítrico, formado a partir de óxidos de nitrógeno y radicales hidroxilo. Consecuentemente, se produce una desnitrificación de la atmósfera, de manera que la ausencia de dióxido de nitrógeno impide la formación de nitrato de cloro, ocurriendo varias reacciones de tipo contrario:
ClH + ClNO3----------------- Cl2 + HNO3
y otras en las que se forma cloro molecular y ácido nítrico. Es decir, se reduce la concentración de óxidos de nitrógeno y se libera cloro de los depósitos.
En primavera, la luz solar incide sobre las moléculas de cloro, disociándolas, formado cloro atómico y comenzando las reacciones disociadoras del ozono ya indicadas y cuando llega la primavera austral, al cloro libre comienza a destruir masivamente el ozono sin que nada se lo impida
Pero no sólo los CFCs...
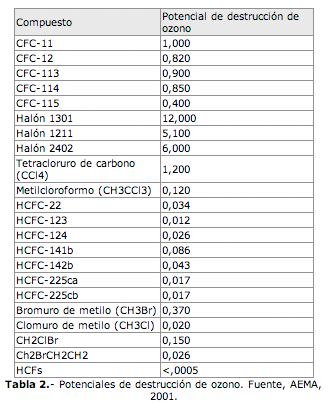
Los CFCs, representan alrededor del 41% del contenido estratosférico de cloro y bromo, pero también:
- El tetracloruro de carbono (CCl4) y el metilcloroformo (CH3CCl3) usado en la limpieza de los metales, cada uno de los cuales supone un 11% de la presencia de haluros estratosféricos.
- Los halones (algunos de ellos decenas de veces más destructores que el cloro) utilizados para combatir incendios (contienen bromo) suponen un 9% y el bromuro de metilo (CH3Br) usado en la agricultura como herbicida, el 3%.
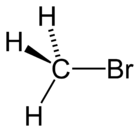
Bromuro de metilo o bromometano
Es un insecticida y nematocida con efectos fungicidas, acaricidas, rodenticidas y herbicidas (semillas en germinación)
El Protocolo de Montreal ha restringido severamente el uso de bromuro de metilo internacionalmente. Sin embargo, en 2004, 3.200 t de bromometano se aplicaron sólo en el Estado de California, (California Department of Pesticide Regulation). Para el mismo año, en Argentina se utilizaron 870 t
ver animación del efecto del bromuro de metilo
Consecuencias de la reducción de la capa de ozono- Aumento de la radiación ultravioleta que llega a la superficie terrestre, originando un aumento de los canceres de piel y del número de personas y animales afectados de cataratas, así como de enfermedades derivadas de deficiencias del sistema inmunitario.
- Una dosis muy elevada de radiaciones UV pueden retrasar la fotosíntesis en las plantas, reducir el tamaño de la hoja, dificultar su creciemiento, dañar la calidad de la semilla y aumentar su susceptibilidad a las malas hierbas y a las enfermedades que conllevaría descenso en la productividad de las cosechas.
- En los oceanos también habría problemas. Un exceso de UV tiende a desorientar a los organismos planctónicos cusándoles la muerte. Si esto ocurriera a gran escala, afectaría a todo el ecosistema oceánico (además de una menor producción pesquera).
- La destrucción de O3 alteraría también al clima. Una reduccion del 5% en el nivel de ozono en la estratosfera sería equivalente a el desplazamiento de las zonas climáticas unos 150 Kms hacia el ecuador.
- La reducción de este gas puede estar cambiando la conducta de la atmosfera. El O3 actúa como un agente calefactor en las capas más altas de la atmósfera al absorber la energía solar. Si desaparece, la estratosfera podría enfriarse afectando al sistema global de vientos, además habría temperaturas extremas y se produciría una alteración en las estaciones y las precipitaciones (efecto invernadero).
Cómo están las cosas en la actualidad
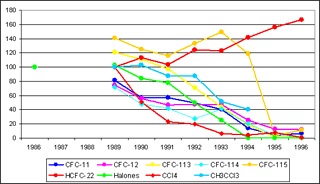
En la Unión Europea, la reducción en la producción de las sustancias que agotan la capa de ozono en el decenio comprendido entre 1986 y 1996 fue notable (ver gráfico). El incremento en la producción de HCFCs se debe a que son sustitutivos de los CFCs, como ya se ha señalado. No obstante, la estabilidad y persistencia de este tipo de compuestos y la duración del proceso de reducción y eliminación de la producción y uso, establecidos en los calendarios de Montreal y Conpenhague, suponen que su concentración en la atmósfera siga incrementandose; en efecto, se espera que la concentración de varios halones llegue a su máximo hacia 2010.
Evolución en la producción de sustancias que agotan la capa estratosférica de ozono.
Se toma como origen 1986 para CFC-11, CFC-12, CFC-113, CFC-114, CFC-115 y HCFC-22;
Se toma como origen 1989, para halones, tetracloruro de carbono y metilcloroformo.
Fuente, AEMA, 2001. El punto inicial, en 1986, corresponde a la totalidad de sustancias.
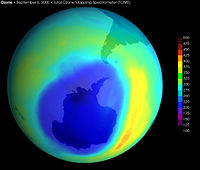
Imagen del mayor agujero de ozono detectado en la Antártida fue registrado en septiembre de 2000.
Datos obtenidos por el instrumento Total Ozone Mapping Spectrometer (TOMS) a bordo de un satélite de la NASA.
Aunque con las medidas tomadas se espera que la capa de ozono se recupere; sin embargo, no se espera que la concentración estratosférica de ozono llegue a los niveles previos a la fabricación y uso de CFCs antes de 2100 en el mejor de los escenarios, que incluiría la ausencia de comercio y utilización ilegales de estos compuestos.
ver animación resumen de los principales
acontecimientos en el deterioro del ozono
Alternativas al uso de los CFCs
- La mejora de instalaciones y optimización de los procesos para evitar el escape de CFCs de instalaciones y equipos anteriores a 1996, a la atmósfera. Los refrigerantes de los diferentes equipos de refrigeración o aire acondicionado pueden ser recuperados, limpiados, remanufacturados y finalemente destruidos.
- Utilización de sustitutos químicos sencillos como etileno, etano, propano que son excelentes refrigeradores aunque tienen como principal inconveniente el hecho de ser inflamables
- Busqueda de nuevos compuestos fluorocarbonados (HFCs) o clorofluorocarbonados con hidrógeno (HCFCs) cuyo potencial destructor de la capa de ozono sea mínimo.