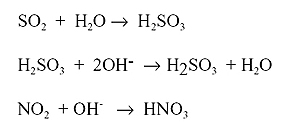EFECTOS DE LOS CONTAMINANTES (continuación)
EFECTOS REGIONALES
LLUVIA ACIDA
Los contaminantes pueden retornar a la superficie terrestre en lugares cercanos a los focos de emisión bien zonas alejadas, originando en este segundo caso el fenómeno conocido como contaminación transfronteriza, ejemplo de lo cual es la lluvia ácida. Este nombre hace referencia al retorno a la Tierra de los óxidos de S y N descargados a la atmósfera en forma de ácidos disueltos en las gotas de lluvia, pero también en forma de nevadas, nieblas y rocíos. Así la actividad en el Reino Unido va a parar a Escandinavia por los vientos dominantes. La actividad de USA va a parar a Canadá.
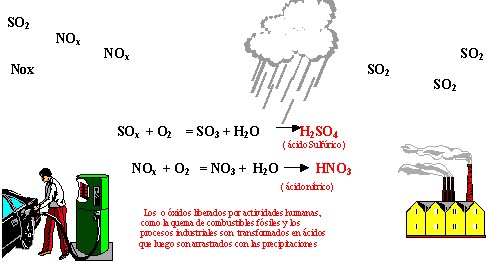
Se trata de la oxidación en fase acuosa o gaseosa de los gases emitidos en procesos de combustión de fuentes fijas y móviles: el SO2 y el NO2. (ya sabemos por qué se producen)
La oxidación se incia generalmente por la acción de un atomo de oxigeno con una molecula de agua y la formación consiguiente de radicales hidroxilos (OH-). Este radical es muy activo y reacciona con los NO2 y SO2 para producir acidos. A su vez, la existencia de radicales libres como el peróxido de hidrógeno y moléculas muy activas pueden aumentar el proceso de formación de acidos.
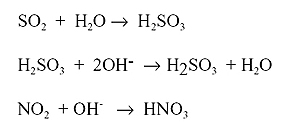
Los acidos formados se disuelven en las gotas de agua de las nubes o se condensan por reacciones en fase gaseosa y se depositan sobre la superficie terrestre mediante dos mecanismos:
- Deposición seca: en forma gaseosa o de aerosoles, en zonas próximas al foco emisor
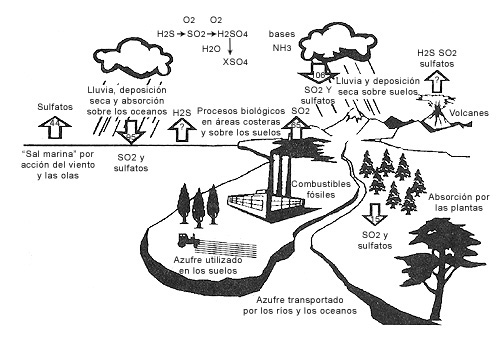
- Deposición húmeda: la mayor parte de los SO2 y NOx, que permanecen en la atmósfera sufren un proceso de oxidación en el que se forma ácido sulfúrico y ácido nítrico que se disuelven en las gotas de agua que forman las nubes, pudiendo ser transportados por el viento a cientos de kilómetros del foco emisor, retornando al suelo por medio de las precipitaciones.

ver animación
La intensidad de la lluvia ácida depende de la velocidad de las reacciones químicas que la originan, la presencia de humedad en la atmósfera y la dinámica de la atmósfera, que traslada los iones (sulfato, nitrato, hidrógeno) a distancias más o menos largas.
Los niveles de acidez de la lluvia se miden por el ph. La escala va del 1 (más acido) hasta el 14 (Más básico) pasando por 7 que se considera neutro. Si la precipitación es inferior a ph 5.6 se considera ácida

Escala de ph y efectos de un aumento de acidez.
Se han registrado precipitaciones de ph inferior a 2
La lluvia acida no mata por si misma a los animales y plantas sino como consecuencia de una serie de procesos que desencadena.
- Mata a los peces al liberar el aluminio en el agua ya que produce la obstrucción de sus branquias.
- En algunas aves la acidez del medio (agua o suelo) hace disminuir el grosor de las cáscaras del huevo.
- El salmón no puede vivir en aguas con ph inferior a 5.5.
- Por debajo de ph 4.0, se restringe la vida orgánica.
- Las plantas son afectadas directamente en su parte aerea al obturar sus estomas de las hojas las partículas acidas y atacar los estratos celulares superficiales y organos reproductivos. Ataca a las cutículas (decoloración de las hojas)

Deforestación por lluvia ácida
- Por otro lado se produce también un debilitamiento de las plantas al modificarse la composición del suelo de donde toma los nutrientes, al favorecer su lixiviación y liberar elementos tóxicos, que los arboles toman por engaño en lugar de los nutrientes.
- Acidifica el suelo y ello conlleva una pérdida de nutrientes.
La mayor acidez en el agua de lluvia registrada en Europa se ha observado en Escocia, donde el pH ha llegado a ser de 2,4. Países como Gran Bretaña o Alemania, muy industrializados, trasladan hacia zonas como Noruega, Dinamarca o Finlandia los contaminantes, donde éstos se depositan. Estos países son receptores de la contaminación al encontrarse al este de los países emisores, dado que en estas zonas el sentido de la circulación general de la atmósfera es del oeste. Ultimamente también en Polonia, checoslovaquia, Suiza y Francia.
Los efectos de la lluvia ácida también se manifiestan en la corrosión de metales y descomposición de materiales de construcción.
Podríamos resumir sus efectos :
- Alteración de la cadena trófica por extinción de la fauna acuatica
- Incremento de la sensibilidad a las plagas al disminuir la vitalidad de la flora terrestre por atrofia radical, ya que disminuye el ph del suelo por la presencia del ion alumnio. La parte catiónica de los elementos metálicos básicos se pierde liberando a la parte electronegativa. El agua reacciona con ciertos aniones aumentando la agresividad de los mismos, por ejemplo, los fluoruros y los cloruros en presencia de vapor de agua se transforma en acido clorhídrico y fluorhídrico respectivamente
- Incremento de la movilidad de las partículas contaminantes al darse pérdida por lixiviación de ciertos cationes metálicos básicos.
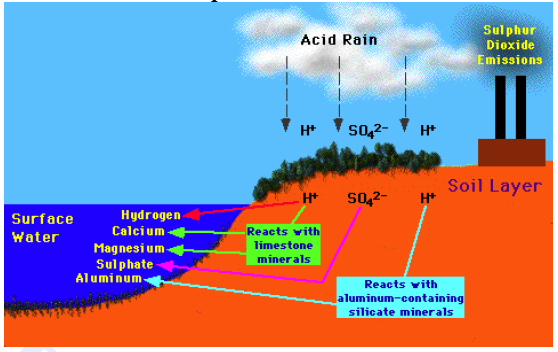
Todo ecosistema tiene un depósito acido natural que puede tolerar y neutralizar antes de sufrir graves daños. Cuando el suelo es calizo lo tolera mucho mejor.
Las medidas para resolver el problema son:
- Reducir la cantidad de contaminantes lanzados a la atmósfera (directivas que obliguen a tratar los gases emitidos por instalaciones de producción de energía y otras industrias con sistemas de control) y limpieza de gases, instalación de catalizadores en vehículos, etc.
- Tratar el depósito de acido en el momento y en el lugar que se produzca. Por ejemplo se ha intentado rociar los lagos con roca caliza molida, proceso denominado encalado. Pero este tratamiento debe realizarse con frecuencia y un cambio súbito en la acidez o alcalinidad del agua puede dañar al ecosistema.