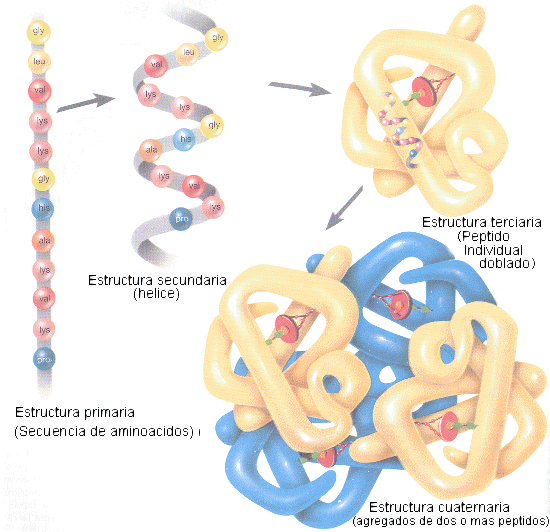PROTEÍNAS II
ESTRUCTURA DE LAS PROTEÍNAS
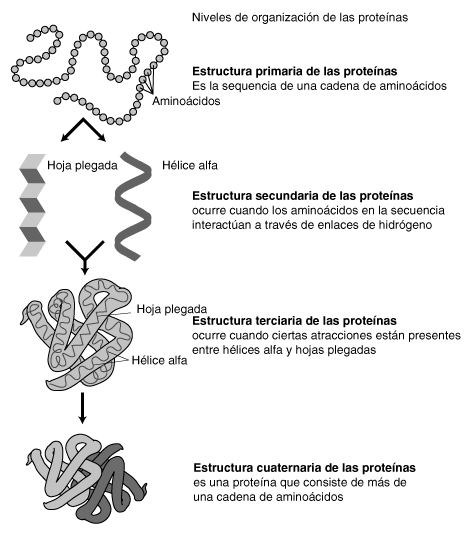
La estructura de una proteina es fundamental, de ella va a depender la función que realiza. Se distinuen en las proteínas cuatro niveles estructurales: estructura primaria, secundaria, terciaria y cuaternaria. El paso de una estructura a la siguiente implica un grado de complejidad mayor.
Estructura primariaViene determinada por los aa' que componen la cadena y el orden en que se encuentran en la cadena polipeptidica. De ella dependen los siguientes niveles estructurales.
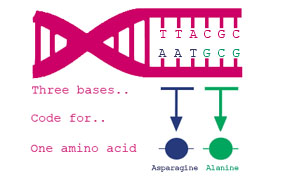
Esta secuencia es única para cada proteína, ya que la información para construirla se encuentra codificada en el ADN. Cualquier cambio de orden de los aa' da lugar a una proteína diferente o perder su función biológica (deja de ser funcional)
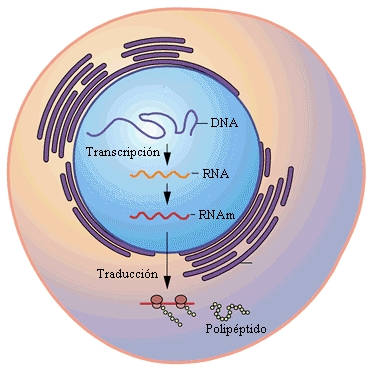
En la traducción, los ribosomas van uniendo los aminoácidos en el orden que indica
el ARNm, el cual se transcribe directamente del ADN
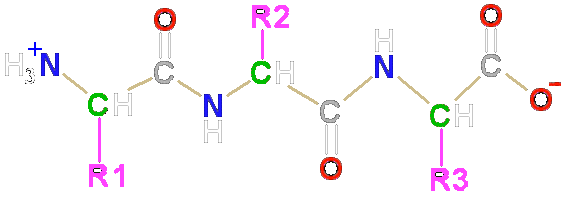
Al formarse el enlace peptídico entre los aminoacidos se originan tres enlaces que se repiten, siguiendo una línea quebrada.
N-C(alfa)
C(alfa) - C (Carboxilo)
C(carboxilo) - N
Los grupos -R de cada aminoácido se proyectan en el espacio, alternativamente arriba y abajo.
La estructura primaria se mantiene gracias al el enlace peptídico, plano y rígido, que puede romperse por hidrólisis, lo que llevaría a la ruptura de los enlaces peptídicos y la liberación de los aminoácidos que formaban la proteína.
Estructura secundaria
Se refiere a como se dispone de la cadena polipeptídica en el espacio a lo largo de un eje.
Es el nivel estructural superior que alcanzan las proteínas fibrosas.
Los tipos más usuales de ordenación secundaria en las proteínas son la alfa-hélice y la ordenación beta o hoja plegada (lámina beta)
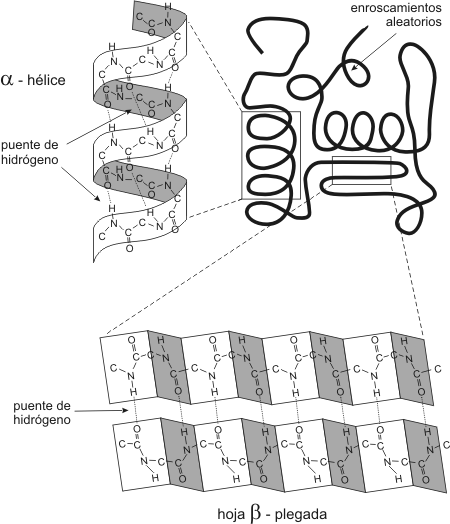
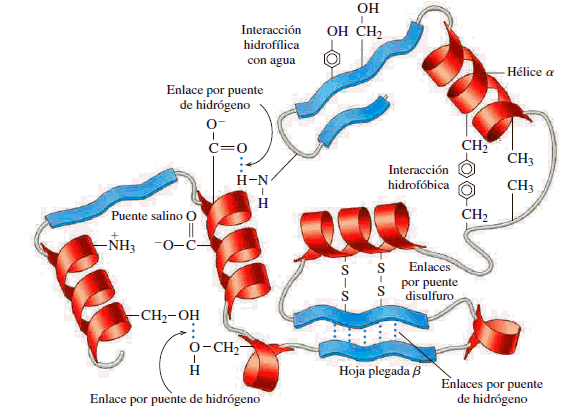
Estructura de alfa-hélice
Se forma al enrollarse sobre si misma la estructura primaria de la cadena polipeptídica.
La ordenación alfa-helice es similar en giro a un tornillo de rosca dextrógira que gira en el sentido de las agujas del reloj.
Los enlaces que permiten girar la estructura hacen que los planos donde se sitúa el enlace peptídico se dispongan alrededor de una helice, con 3,6 aa' por cada espira o por vuelta (es decir, cada 5 vueltas, 18 aa').
La hélice es estable gracias a los enlaces de H que se establecen entre el atomo de H de un aa' y el atomo de O del grupo carbonilo del cuarto aa' que le sigue en la cadena polipeptídica. Además esta disposición permite que todos los restos -R queden situados hacia el exterior de la helice.
Estructura secundaria de una proteína (en alfa-hélice)
Esta disposición en alfa helice es estable pero cuando existen aa' muy polares como Glu, Lys y Pro, esta estructura se ve interrumpida quedando en forma lineal.Un ejemplo de proteínas con alfa-hélice son las alfa-queratinas, abundantes en las células epidérmicas animales y que forman estructuras como el pelo, plumas, uñas, cuernos, lana...
Estructura de lámina-beta
La estructura ß (beta) o de lámina plegada de forma aplanada y extendida, está formada por la interacción entre polipéptidos situados en posición paralela o antiparalela según estén dispuestos en el mismo o distinto sentido.
También esta conformación se estabiliza gracias los enlaces de H que se forman entre dos cadenas laterales. Estas cadenas laterales se encuentran tanto por debajo como por encima del plano en zig-zag de la hoja plegada.
Esta estructura forma grandes regiones en la mayoría de las proteínas globulares constituyendo una especie de trama laminar sobre la que se construye la proteína.
La mayoría de las proteínas fibrosas se da en alfa-hélice, mientras que en las proteinas globulares se dan los dos tipos, la alfa-hélice y la ordenación beta. La estructura laminar formada le confiere flexibilidad, no más elasticidad. Un ejemplo de estas proteínas es la fibroína de la seda.
En aquellas zonas donde no existe ordenación alguna, ni alfa ni beta, las proteínas presentan una estructura al azar, lo cual ocurre cuando las características de las cadenas laterales no permite la formación de alfa o beta.La estructura secundaria de una proteina puede variar. Así, la alfa queratina del pelo y de la lana en estado natural adquiere una conformación alfa-hélice pero si la sometemos a calor húmedo y tracción se rompen los enlaces de H que mantenían su estructura y la proteína duplica su longitud adquiriendo la conformación beta, que permite una mayor longitud.
Estructura secundaria en alfa-hélice y hoja-beta plegada en diferentes partes
de la proteína
Hélice de colágeno
Este tipo de estructura está constituida por tres cadenas polipeptídicas que se enrollan de forma levógira. Esta hélice es lo que constituye la hélice de colágeno. No están tan arrolladas como las hélices alfa.
Hélice de colágeno
Una característica de estas estructuras es la composición en cuanto a aminoácidos, que sigue el mismo patrón Gly-X-Y-Gly-X-Y etc. y es para todas las cadenas. X e Y son cualquier aminoácido, aunque existen preferencias por la prolina, hidroxiprolina y menos por la lisina. La glicina es el aminoácido más pequeño y el único capaz de colocarse dentro de la hélice, los demás siempre hacia afuera. La hélice la favorecen los más pequeños.La estabilidad se mantiene por los enlaces de hidrógeno entre el grupo amino de los enlaces peptídicos en los que participa la glicina y el carbonilo de cualquier enlace peptídico. Los enlaces se establecen tanto en cada hebra como entre hebras, por lo tanto son enlaces intermoleculares intercatenarios.
También contribuyen a la estabilidad las fuerzas de van der Waals, estas interacciones son de tipo físico (por atracción entre aminoácidos).
También se pueden formar enlaces covalentes entre restos de aminoácidos (lys). Estos suelen ser entre cadenas, se forman de manera espontánea y se puede destruir con el calor.
El colágeno es una proteína que se sintetiza en los fibroblastos. Forma parte de piel, tendones, vasos sanguíneos, cartílagos y huesos. Disminución: envejecimiento. Industria alimentaria.
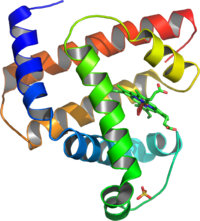
Estructura terciaria
Es raro para una proteína entera permanecer con la estructura de alfa-hélice u hoja ß-plegada. La mayoría de ellas adquieren formas tridimensionales complejas denominadas estructuras terciarias
La estructura terciaria es la forma en la que la cadena polipeptídica se enrolla y se pliega dando lugar a disposiciones espaciales más o menos esféricas.
Las interacciones locales entre aminoácidos próximos originan helices-alfa, hojas-beta u otras formas de estructura secundaria.
Estos subconjuntos se organizan en dominios, que comprenden entre 30 y 150 aminoácidos, y que actúan a modo de unidades más o menos coherentes. La disposición geométrica de los dominios es lo que constituirá la estructura terciaria.
Características de la estructura terciaria:- los aa' polares se sitúan en la parte externa (interacción con el agua) y en la parte interna del ovillo los aa' no polares.
- la molécula se hace muy compacta y en su interior se crean espacios o huecos con una importante función biológica en algunas proteinas.
Existen varios factores que explican la estructura terciaria:
• La existencia de aa' como la prolina y la hidroxiprolina que interrumpen la estructura alfa hélice.
• Los restos (R) hidrofóbicos tenderán a alejarse de ese medio forzando cambios en la estructura que se replegará intentando crear zonas internas alejadas y protegidas del agua.
• Los restos de cisteina (-SH) pueden formar puentes disulfuro entre cadenas distintas o dentro de la misma cadena originando nuevos cambios en la cadena (Cistina)
• El ph del medio también puede provocar cambios. Si el ph es próximo a 7, sabemos que el resto R de muchos aminoácidos va a tener carga. Así, si en una proteína existen dos restos contiguos con la misma carga se repelerán. Y al revés, una atracción entre restos cargados con distinto signo y situados en cadenas distantes puede provocar un cambio total en la conformación de la cadena.
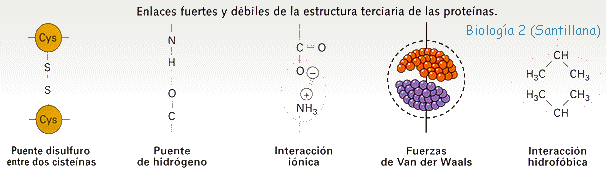
Tipos de enlaces entre las cadenas laterales que hacen que se forme la estructura terciaria:Enlaces disulfuro: (-S-S-) Enlace covalente: fuerte. Se da entre dos cisteínas
Enaces iónicos: Se da entre restos polares con carga aá ácidos (-) y básicos (+) Ej. Glutámico - Lisina
Enlaces de hidrógeno: Entre restos polares sin carga. Ej. Serina, treonina, tirosina
Fuerzas de Van der Waals (interacciones hidrofóbicas): Entre restos polares o no polares. Alanina, leucina, fenilalanina. Estas interacciones son debidas a irregularidades en la distribución de los electrones alrededor del núcleo dando lugar a dipolos instantáneos que impican atracciones y repulsiones de tipo electrostático.
Tipos de enlaces entre las cadenas laterales (-R) en la estructura terciaria
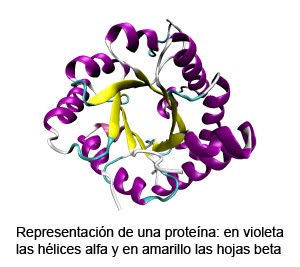
Poseen estructura terciaria las proteínas globulares que presentan cadenas polipeptídicas en las que alternan tramos con estructura de alfa-hélice y lámina-beta que se pliegan hasta alcanzar formas más o menos esféricas. Estas proteínas poseen funciones transportadoras, reguladoras...
Estructura terciaria de la mioglobina
Estructura terciaria y tipos de enlaces
Estructuras supersecundarias (motivos)
(dentro de la estructura terciaria)Las estructuras supersecundarias pueden definirse como combinaciones de Alfa-helices y estructuras Beta conectadas a traves de asas o lazos, que forman patrones que estan presentes en muchas proteínas diferentes. Estos plegamientos se estabilizan a traves de la misma clase de enlaces que mantiene a la estructura terciaria.
También se utiliza el termino “motivo” (“motif” en ingles) para describir a estas estructuras supersecundarias.
Estas estructuras pueden ser relativamente simples, como:
- Alfa-Alfa (dos helices alfa unidas por una asa)
- Beta-Beta (dos Beta-hebras unidas por una asa)
- Beta-Alfa-Beta (Beta-hebra unida por un asa a una alfa-helice que esta a su vez unida a otra Beta-hebra por otro lazo)
o estructuras mas complejas, como:- el motivo llamado de “Llave Griega” (“Greek key”)
- o el motivo Barril Beta (“beta-barrel”).
Motivo de "Llave o clave Griega"
Una Clave griega es un patrón repetitivo usado en arquitectura, joyería y tejidos. Debe su nombre al hecho de que constituye un tema decorativo de la Antigua Grecia. Ha sido relacionado con la imagen del laberinto donde se hallaba confinado el Minotauro, según la mitología de la isla de Creta.
Barril beta
Lo interesante es que estas estructuras repetitivas pueden diferir mucho en su estructura primaria, y ademas, pueden estar presente en proteínas muy diferentes.
Algunas proteínas con estructura terciaria no tienen estructuras supersecundarias.
Dominios estructurales
Son unidades estructurales compactas, estables, dentro de una proteína, formadas por segmentos de una cadena peptídica que se pliegan de forma independiente, con una estructura y funcion distinguible de otras regiones de la proteína y estabilizadas por las mismas fuerzas que la estructura terciaria.
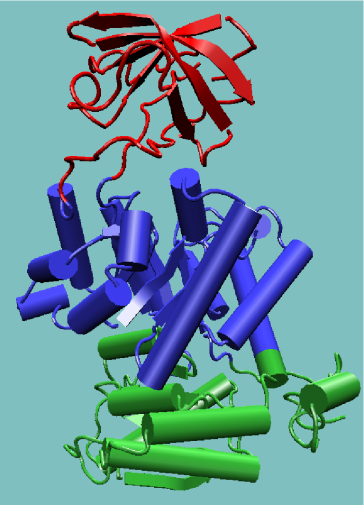
Tres dominios en la Piruvato Kinasa (enzima)
Los dominios estructurales pueden considerarse como unidades elementales de la estructura de las proteínas, que son capaces de plegarse y de funcionar de una manera relativamente autonoma.
Los dominios se caracterizan por poseer una geometría casi esférica específica con un interior hidrofóbico y un exterior polar.
Son muy estables, compactos y de aspecto globular y se enlazan entre ellas mediante codos estrechos con cierta movilidad.
Esto conlleva una gran importancia biológica: presencia de distintas cargas, huecos hidrofóbicos en su molécula, distintas formas....: actividad catalítica (enzimas).
Por ejemplo, en la enzima hexoquinasa, el sitio activo de unión del sustrato glucosa está en una hendidura entre dos dominios, cuando la glucosa se une a la hendidura, los dominios colindantes se cierran sobre el sustrato, atrapándolo para la fosforilación.
Un dominio a veces esta formado por motivos, pero otras veces no contiene ninguno.
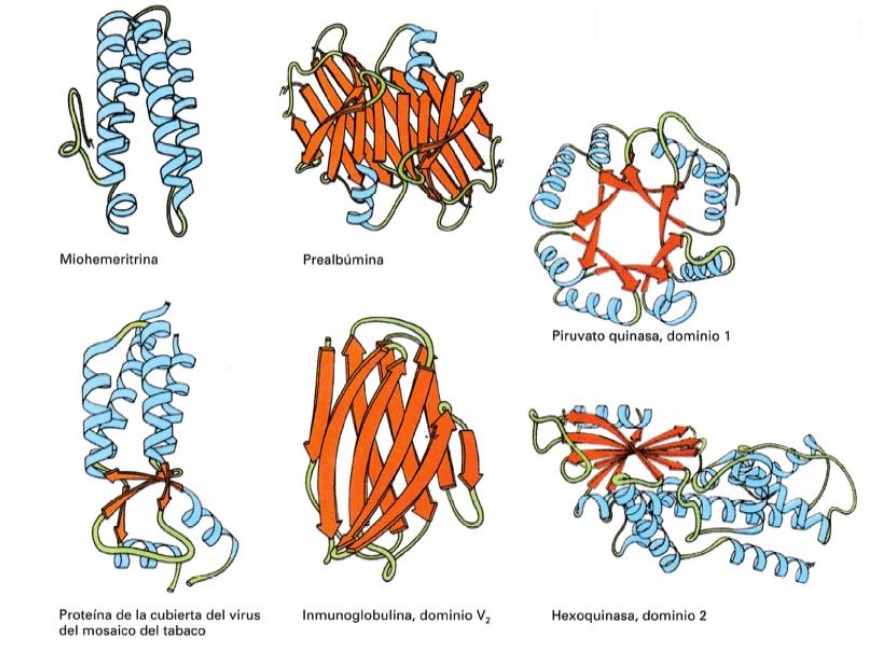
Proteínas fibrosas y globulares
Algunos ejemplos de proteínas con estructura terciaria
(alfa-hélices en color azul. B-láminas en color naranja)
Estructura cuaternaria
Constituye el máximo grado de evolución tridimensional de una proteína de caracter globular (las proteínas fibrosas no pasan de la terciaria).
La estructura cuaternaria se da en aquellas proteínas que están formadas por la asociación de varias cadenas polipeptídicas plegadas con estructura terciaria.
Las proteínas con estructura cuaternaria se denominan oligoméricas y cada una de las cadenas que las forman subunidades o protómeros.
Diferentes PROTOMEROS o MONOMEROS (generalmente en número par) al asociarse dan un OLIGOMERO (DIMERO, TETRAMERO...) que constituye la estructura cuaternaria de una proteína. Muchas proteinas de gran tamaño están formadas por la asociacion de varias cadenas polipeptídicas iguales semejantes o diferentes (por ejemplo en la hemoglobina).
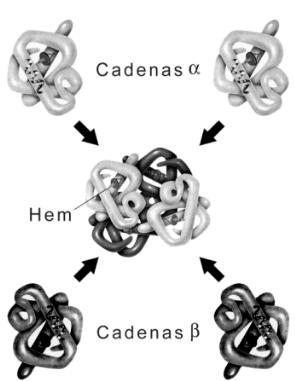
Un ejemplo de proteína con esructura cuaternaria: Hemoglobina
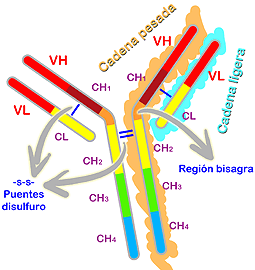
Esta estructura se mantiene gracias a interacciones de tipo debil (nunca encontraremos enlaces covalentes como en la terciaria exceptuando el caso de las inmunoglobulinas en la que sí se dan enlaces disulfuro en su estructura cuaternaria para una mayor estabilidad) entre las cadenas laterales de aminoacidos de diferentes cadenas.En general, los enlaces son del tipo de enlaces de H y enlaces hidrofóbicos. Aunque sean de tipo debil estas interacciones, son muchísimas y esto le da estabilidad a la proteína.
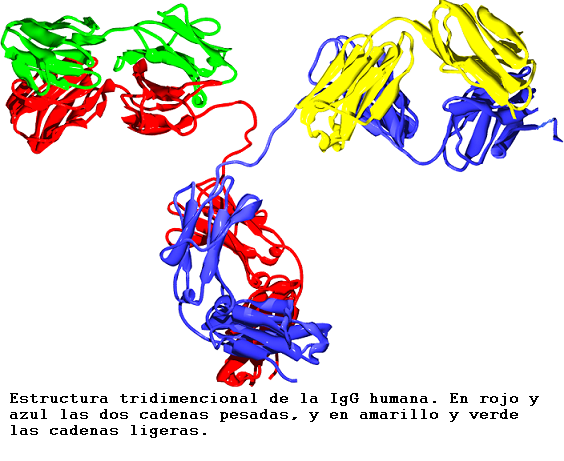
Estructura cuaternaria en la inmunoglobulina humana
Otro ejemplo de estructura cuaternaria lo encontramos en la hemoglobina donde las interacciones hidrofóbicas, los enlaces de hidrógeno y los enlaces iónicos ayudan a mantener las cuatro subunidades juntas para formar una molécula funcional, así cada subunidad de hemoglobina se pliega de manera similar a la estructura terciaria de mioglobina.
La hemoglobina dentro de los glóbulos rojos está constituida por dos cadenas alfa y dos cadenas beta, que permiten tomar una molécula de oxígeno. Para "atrapar" moléculas adicionales de oxígeno, las cuatro subunidades cambian ligeramente su conformación y los enlaces iónicos se rompen para exponer las cadenas y facilitar esta función.
Estructura cuaternaria de la hemoglobina.
Observar los grupos hemo (Fe) en cada dominio
El hecho de construir proteínas a partir de subunidades idénticas tiene muchas ventajas
- Supone un ahorro en la información genética
- Cualquier error en la síntesis de una subunidad supone unicamente la sustitución de la cadena polipeptidica defectuosa por otra y no de la proteína completa ya que los mecanismos de ensamblaje pueden no reconocer a la subunidad defectuosa y se excluye.
- Las subunidades se construyen a través de enlaces de baja energía lo cual hace que se puedan asociar y disociar con facilidad cuando así lo requiera la célula.
- La estructura cuaternaria de una proteina le confiere a la proteína propiedades alostéricas, es decir capacidad de regulación de su actuación.
¡No todas las proteínas alcanzan la estructura cuaternaria!
Sólo algunas proteínas globulares
La asociación espontánea de las cadenas de polipéptidos no se detiene en la estructura cuaternaria. Hay ejemplos en los cuales varias enzimas se asocian para realizar funciones en cooperación constituyendo los complejos multienzimáticos que se utilizan para catalizar secuencias de reacciones.
ver animación estructura de las proteínas
ver animación de la estructura de las proteínas II
ver animación de la estructura de las proteínas III
ver vídeo estructura proteínas
otro vídeo de la estructura de las proteínas
La conformación nativa de las proteínas y su función biológica
En condiciones fisiológicas, a ph 7 y a una temperatura de 37°C (en homeotermos, por ejemplo) y en un entorno acuoso e isotónico, cada proteína adopta la conformación más estable posible, que se denomina conformación o estructura nativa. Las proteínas sólo manifiestan actividad biológica cuando se encuentran en su estructura nativa.
La conformación nativa de una proteína es el resultado de la combinación de las estructuras secundaria, terciaria y/o cuaternarias que puedan coexistir en esa proteína.
La información necesaria para que una proteína alcance su estructura nativa se encuentra en su propia secuencia de aa'.
Sin embargo, algunas proteínas no pueden alcanzar su conformación funcional por si mismas y requieren de la ayuda de unas proteínas denominadas chaperonas, para conseguir un plegado adecuado
Las proteínas tipo chaperonas son un conjunto de proteínas presentes en todas las células cuya función es la de ayudar al plegamiento de otras proteínas, tras su síntesis o durante su ciclo de actividad (por ejemplo, en defensa de estrés térmico).
Estas chaperonas no forman parte de la estructura primaria de la proteína funcional, sino que sólo se unen a ella para ayudar en su plegamiento, ensamblaje y transporte celular a otra parte de la célula donde la proteína realiza su función. Los cambios de conformación tridimensional de las proteínas pueden estar afectados por un conjunto de varias chaperonas que trabajan coordinadas, dependiendo de su propia estructura y de la disponibilidad de las chaperonas.
Un tipo de chaperonas, las chaperoninas facilitan directamente el plegado de las proteínas en bacterias, mitocondrias y cloroplastos
La chaperonina GroEL-GroES de Escherichia coli, con una disposición en cilindro hueco capaz de reconocer, albergar y plegar a determinados polipéptidos.
ver animación plegamiento de las proteínas
PROPIEDADES DE LAS PROTEÍNAS
Ya hemos visto que las propiedades de las proteínas dependen principalmente de las características de las cadenas laterales de los aminoácidos que las componen y por tanto de su capacidad para reaccionar con otros radicales o con el medio que las rodea.
Las funciones biológicas que desempeñan, dependen a su vez de las propiedades. Además son muy útiles las propiedades para los métodos de separación. Las principales propiedades son:
Solubilidad
Depende del tamaño y de la forma de la molécula, de la disposición de los restos, del contenido en sales minerales y del ph del medio.
Composición de la moléculaEn general, una proteína o una zona de la misma se hace lipófila o hidrófoba cuando posee muchos aminoácidos no polares en el exterior (val, Leu, Ile, Ala....) y es hidrófila cuando los aminoácidos que se sitúan en el exterior de la molécula son polares (Asp, Glu, Lys...).
Como ejemplos, las proteínas que están en el citoplasma, las hormonas proteicas o las que circulan por el suero sanguíneo son hidrosolubles.
Tamaño y forma de la moléculaLas proteínas pequeñas y globulares se disuelven mejor que las grandes o fibrosas.
Por ejemplo, las proteínas estructurales como la queratina del pelo y uñas, son fibrilares e insolubles en agua.
Ph del medioCuando el ph del medio coincide con el pI (punto isoeléctrico), la carga de la proteína será cero y tendrá poca afinidad por el agua y no se disolverá.
TemperaturaLa solubilidad de las proteínas aumenta con la temperatura siempre que se mantenga en un rango que permita que la proteína mantenga su conformación nativa.
A partir de los 40°C se suele producir un descenso en la solubilidad de las proteinas por efecto de la desnaturalización (fiebre).
Fuerza iónica del medio (concentración salina)
Si se incrementa la concentración de sales en el medio, los iones de las sales "roban" la capa de solvatación que crea el agua a las moléculas de las proteínas, haciendo que éstas precipiten (disminuye su solubilidad).
Especificidad
Las proteínas que existen en los seres vivos son exclusivas de cada especie. Aquellas proteínas que desempeñan las mismas funciones en especies distintas suelen presentar una conformación muy similar aunque nunca idéntica, es decir, hay una variación en los aminoácidos de la cadena.
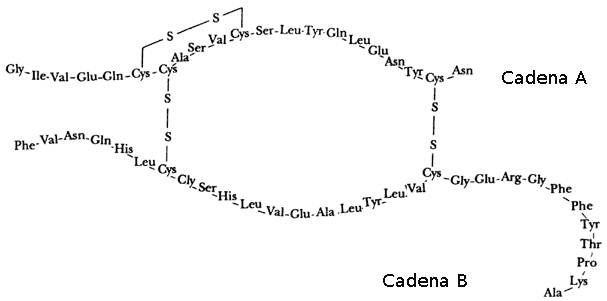
Insulina humana
Así, el conjunto de proteínas que posee una especie es una huella digital de una especie en concreto.
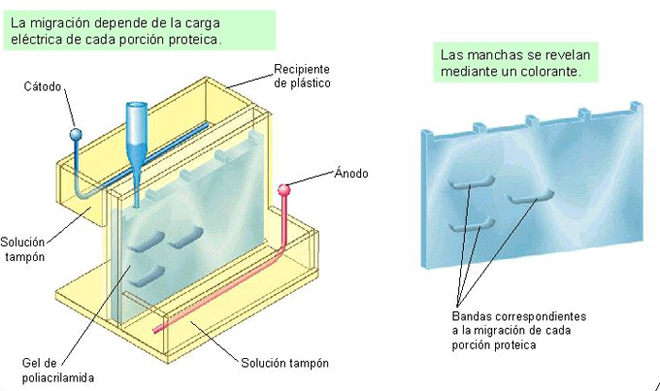
Esta propiedad de especificidad nos da pie para detectar la proximidad o la lejanía filogenética (grado de parentesco) entre diversas especies mediante una técnica denominada electroforesis que no es más que la comparación de las proteínas de diferentes especies para determinar si pertenecen a la misma o especie distinta.
Electroforesis en gel de poliacrilamida
La especificidad proteica es la causa de la existencia de rechazos en los transplantes de corazón, riñon, hígado, etc....Se debe a que el propio sistema inmunológico ataca cualquier proteína que le sea extraña aun en el caso de la misma especie, en este caso la humana. Es decir, la especificidad de las proteinas no solo es a nivel de especie sino también a nivel individual.
Desnaturalización
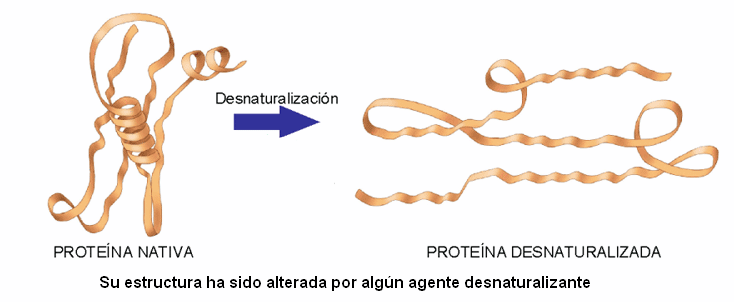
La mayor parte de las proteínas se pliegan espontaneamente, adquiriendo la conformación nativa más estable como ya hemos visto.
Sin embargo cuando a las proteínas se las trata con medios físicos (temperatura, agitación, irradiación U.V., ultrasonidos, ondas de alta frecuencia, altas presiones) o por medios químicos (sustancias de caracter aniónico, disolventes orgánicos, urea, guanidina, detergentes aniónicos o variaciones del Ph, con acidos o bases), la proteína se desnaturaliza.
El proceso de desnaturalización no es más que la rotura de los enlaces o puentes de H o de otras interacciones débiles que mantienen la estructura tridimensional.
La desnaturalización nunca afecta a los enlaces peptídicos, es decir, la estructura primaria queda intacta.
Podemos definir dos tipos:
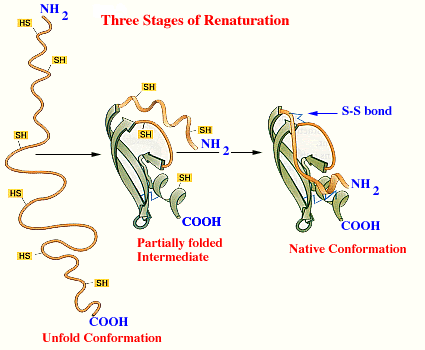
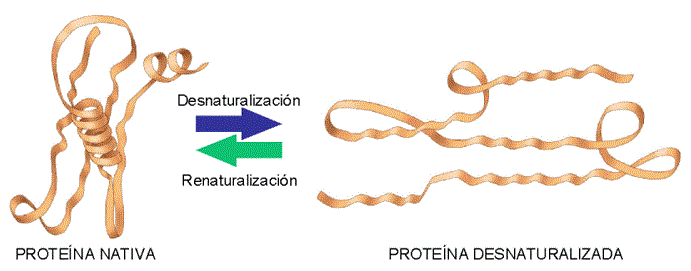
Desnaturalización reversibleSi la desnaturalización es suave, se puede volver de nuevo a su conformación original cuando se restauren las condiciones iniciales del medio (pequeños aumentos de temperatura). El proceso se denomina renaturalización
Desnaturalización reversible de una proteína
Desnaturalización irreversibleCuando el tratamiento es fuerte (un aumento del ph por encima de 8 o una disminución del mismo por debajo de 3; o un aumento de temperatura por encima de 60°, la desnaturalización es irreversible).
Ejemplos de este tipo de desnaturalización son cuando se corta la leche y la caseina (proteína de la leche) antes soluble, al perder su conformación, precipita y se hace insoluble. Otro ejemplo, es cuando se fríe un huevo, la albúmina (clara del huevo) se coagula al romperse su estructura helicoidal.
Desnaturalización irreversible de las proteínas de la leche (por descenso del ph)
y del huevo (por aumento de la temperatura)
Generalmente la desnaturalización se debe a que la estructura globular pasa a filamentosa y esto se traduce en una pérdida de las funciones biológicas (que dependían de su conformación) y de una disminución de la solubilidad terminando por precipitar.
ver animación desnaturalización proteínas
ver otra animación desnaturalización proteínas (en inglés)