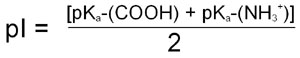PROTEÍNAS I
Con el nombre de proteínas se designan un conjunto de compuestos orgánicos formados por C, H, O y N y cantidades menores de P y S. Con menor frecuencia intervienen I, Ca, Fe, Mg y otros elementos.
Químicamente, las proteínas son polímeros lineales, no ramificados, de unas moléculas denominadas alfa-aminoácidos. La unión entre ellos se realiza a través de un enlace peptídico liberándose una molécula de agua.
Constituyen el 50% del peso seco de un ser humano. Son las macromoléculas que mayor número de funciones realizan entre todas las moléculas que integran los seres vivos. Constituyen los componentes más abundantes en las células y además desempeñan un papel clave en casi la totalidad de los procesos biológicos.
Dentro de las proteinas también están los enzimas.
Las proteínas pueden unirse a otras biomoléculas como glúcidos (glucoproteínas) o lípidos (lipoproteínas)
Seegún el número de aminoácidos que integran cada polímero, se distinguen:Péptidos: cortas cadenas de aminoácidos entre 2 y 100 aminoácidos. Dipéptido, tripéptido...
- Un oligopéptido posee entre 2 y 10 aa'
- Un polipéptido con un número de aa' comprendido entre 10 y 100 aa'Proteínas: más de 100 aa'.
- Proteínas simples: formadas exclusivamente por aminoácidos
- Proteínas conjugadas o heteroproteínas: poseeen una parte proteica (formada por aminoácidos) y una parte no proteica (grupo prostético)
AMINOACIDOS "los ladrillos de las proteínas"
Estructura
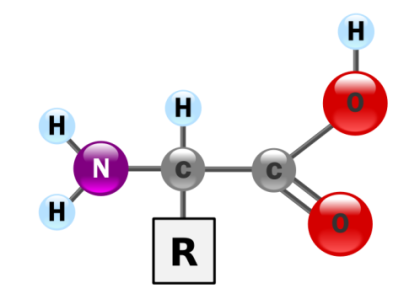
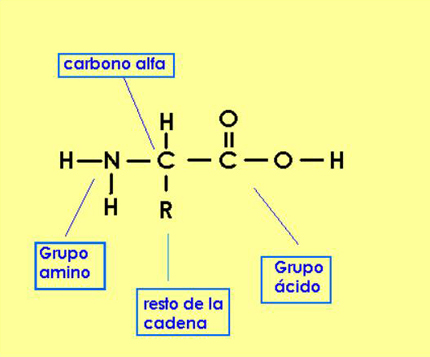
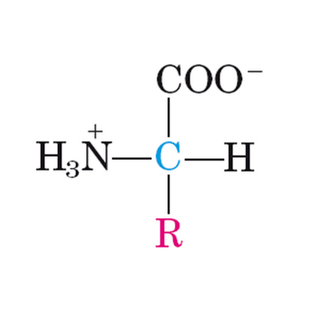
Los aminoácidos constituyen las unidades básicas o monómeros de las proteínas. Su estructura química está compuesta de modo general por poseer un grupo carboxilo (-COOH) y un grupo amino (-NH2) unidos a un carbono que ocupa la posición alfa (de ahí, el nombre de alfa amino-ácidos).
Unidos también a este carbono tenemos un átomo de hidrógeno y una cadena lateral de mayor o menor complejidad llamada radical (R) o cadena lateral. Serán las diferentes configuraciones químicas de esta cadena las que van a marcar las diferencias entre los aminoácidos así como sus diferentes propiedades y a su vez de las proteínas de las que forman parte.
Estructura química general de un aminoácido
Se han identificado unos 150 alfa-aminoácidos o derivados de ellos en el interior de los seres vivos pero no todos forman parte de las proteínas. A los aminoácidos que forman parte de las proteínas: Aminoácidos proteicos o proteinogénicos. Hasta hace relativamente poco se consideraban en número de 20. Hoy, se conocen 22, aunque el número 22 es la pirrolisina (Pyl) que sólo está presente en algunos procariotas.
Si hacemos cálculos, podemos ver que la cantidad de dipéptidos
que pueden formarse con 20 aminoácidos, sería 20*2= 400
El conjunto de proteinas de un individuo constituyen la verdadera esencia o huella digital o genética de un individuo o especie.
Aminoácidos esenciales (10): Deben incorporarse con la dieta: Val, Leu, Ile, Met, Phe, Tre, Trp, Lys (nuestro cuerpo no puede sintetizarles y necesita de su aporte desde el exterior). La arginina y la histidina son esenciales para los lactantes y niños de corta edad.
Algunos aminoácidos:
Glicocola o Glicina: Gly, (G) >> R=H
Alanina: Ala, (A) >> R= CH3
Serina: Ser, (S) >> R=CH2OH
Fenilalanina: Phe, (F) >> R=CH2-fenil.
Tirosina: Tyr, (Y) >> R=CH2-fenol.
Cisteína: Cys, (C) >> R=CH2-SH.
Ac. glutámico: Glu, (E) >> R=CH2-CH2-COOH
Lisina: Lys, (K) >> R=CH2-CH2-CH2-CH2-NH2Construir las fórmulas
Clasificación
Vamos a clasificar los aminoácidos atendiendo a las características que presentan sus cadenas laterales (R), si es polar o apolar y si tiene carga negativa, positiva o neutra.
La polaridad es una propiedad de las moléculas que representa la desigualdad de las cargas eléctricas en la misma. Esta propiedad se relaciona con otras propiedades químicas y físicas como la solubilidad, punto de fusión, punto de ebullición, fuerzas intermoleculares, etc.
Grupo I: Aminoácidos hidrófobos con cadenas laterales apolares (no polares): R no polar, grupos hidrófobos, Fuerzas de Van der Waals.
Grupo II: Aminoácidos hidrófilos con cadenas laterales polares neutras (no ionizables): R polar, grupos hidrófilos. Sin carga a ph 7: R con grupos polares sin carga. Tienden a situarse en la superficie de las proteínas. Puentes de H.
La selenocisteina (Sec), uno de los últimos aminoácidos proteinógenos descubiertos también se incluiría en este grupo. Es similar a la cisteína, pero el azufre ha sido sustituido por selenio
Grupo III: Aminoácidos hidrófilos con cadenas laterales polares con carga: R con grupos muy polares con carga. Fuerzas electrostáticas
- Ácidos: R con grupo carboxilo, exceso de carga - a ph 7
- Básicos: R con grupo amino, exceso de carga + a ph 7
ver animación clasificación de los aminoácidos
Propiedades de los aminoácidos
Sólidos, solubles en agua, cristalizables, incoloros (o poco). Algunos como la fenilalanina o el ácido aspártico poseen sabor dulce. pto fusión > 200 ºC. Carácter anfótero. Iones dipolares. Punto isoeléctrico: pH para ion híbrido: carga neta= 0. Puntoisoeléctrico Isomería. C* alfa>> Estereoisómeros, proteicos L. Estereo Actividad óptica +,-.
Propiedades opticas e isomería
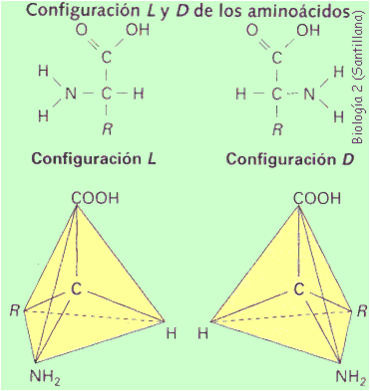
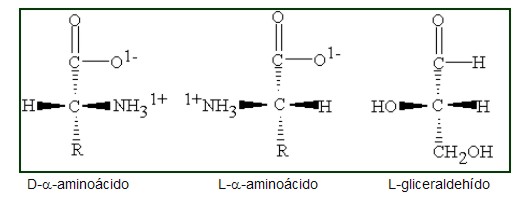
El atomo de carbono que ocupa la posición alfa es asimetrico en todos los aa' a excepción de la glicina ya que posee 4 radicales distintos. Este hecho les hace opticamente activos de modo que en disolución desvían el plano de luz polarizada. Como los enlaces del atomo de C poseen una configuración tetraédrica serán posibles dos configuraciones distintas para cada aa' que serán imágenes especulares o estereoisómeros.Por convenio se ha establecido que pertenecen a la serie D si el grupo amino está situado a la derecha y la serie L si está a la izquierda. En este caso al igual que en los azúcares se toma como modelo el gliceraldehido.
Configuración L y D en un aminoácido, en función de la posición del grupo amino.
La disposición D o L es independiente de la actividad óptica que presenta la molécula. Por tanto un D-aa' puede ser dextrógiro o levógiro.
Propiedades acido-básicas. Punto isoelectrico de un aa'. Carácter anfótero
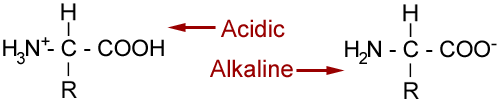
Los aminoácidos poseen carácter anfótero, es decir, pueden actuar como ácidos (tendencia ceder protones) o como bases (tendencia a captar protones). Esto depende del ph de la disolución.En soluciones cuyo ph esté próximo a 7, los aminoácidos están ionizados. En este caso, el grupo amino capta un protón actuando como una base y el grupo acido pierde un protón y actúa como un ácido. Además no debemos olvidar el estado de ionización en que se encuentra la cadena lateral.
- En medio acido, el aa' tiende a captarlos y se carga positivamente, actúa como una base
- En un medio básico, el aminoácido libera protones y queda cargado negativamente, comportándose como un ácido.
Estado de ionización de un aminoácido en medio ácido y en medio básico
Todo aa' puede equilibrar sus cargas positivas y negativas, de modo que su carga neta sea cero. Ello ocurre a un ph dado, distinto para cada aminoácido. A este ph de le denomina punto isoeléctrico de un aminoácido y su valor se representa por pI.
El punto isoeléctrico es el pH al que una sustancia anfótera tiene carga neta cero.
La constante de disociación ácida, Ka, (también conocida como constante de acidez o constante de ionización ácida) es una medida cuantitativa de la fuerza de un ácido en solución: a mayor valor, más fuerte es el ácido, y más disociado estará el ácido, a una concentración dada, en su base conjugada y el ión hidronio. La fuerza de una base está cuantificado por el valor de Ka de su ácido conjugado.pKa es el logaritmo negativo de la constante de disociación de un ácido débil
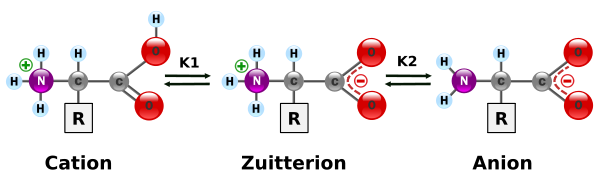
Cuando el ph de la disolución se corresponde con el punto isoeléctrico de cada aminoácido, aparecen en forma de iones dipolares o zwitteriones, es decir, están totalmente ionizados pero son eléctricamente neutros. Esto ocurre porque el protón del grupo carboxilo es abstraído por el grupo amino NH2 que está en posición alfa y quedando este como grupo amoníaco NH3+.
Aminoácido en disolución (totalmente ionizado)
Un zwitterión (del alemán "zwitter" "híbrido", "hermafrodita") es un compuesto químico que es eléctricamente neutro pero que tiene cargas positivas y negativas sobre átomos diferentes
Forma predominante cuando ph › pI; cuando ph = pI; y cuando ph ‹ pI
Solubilidad y punto de fusión de los aminoácidos
La bipolaridad de los aa' similar a la del agua, explica que la solubilidad de estos en ella sea mayor de lo que cabría esperar de acuerdo con su masa molecular y estructura. Del mismo modo, su punto de fusión es bastante elevado (> 200°C), al existir atracciones iónicas que poseen energías de enlace más fuertes que las de Van der Waals.
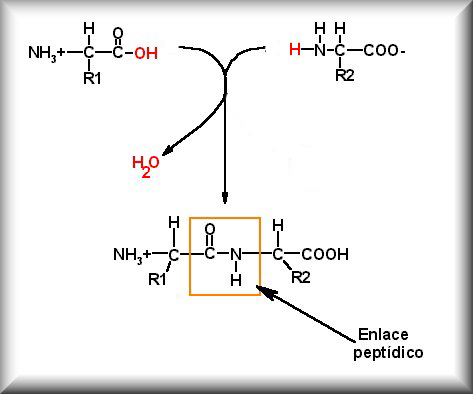
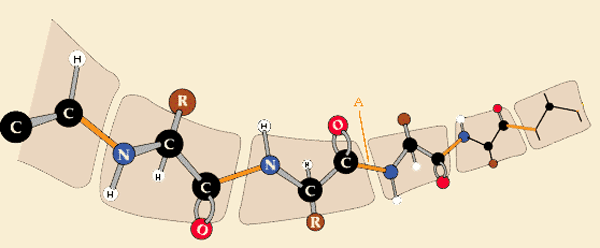
ENLACE PEPTIDICO
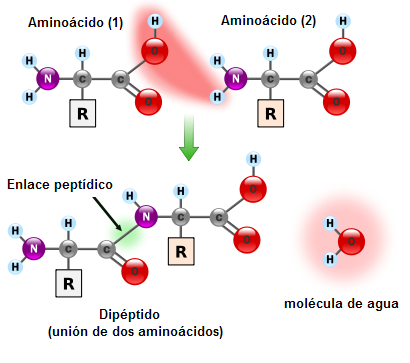
Es un enlace covalente de tipo amida secundaria muy estable que se establece entre el grupo alfa-carboxilo de un aminoácido y el grupo alfa-amino de otro aminoácido. En este enlace se libera una molécula de agua y se forma un dipéptido.
Formación del enlace peptídico entre dos aminoácidos
Enlace peptídico
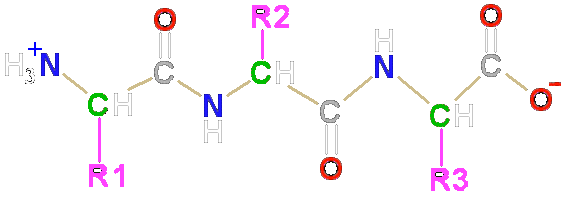
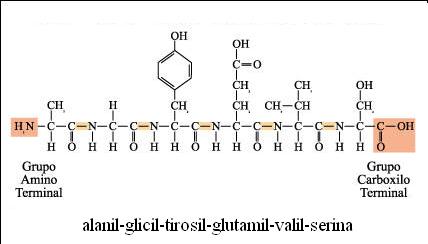
Tres aminoácidos pueden unirse mediante dos enlaces peptídicos y formar un tripéptido. Del mismo modo pueden unirse muchos aminoácidos dando lugar a polipéptidos y proteínas.
Péptido
El extremo de un péptido que tiene el grupo alfa-amino libre es el extremo aminoterminal o N-terminal. El extremo en el lado opuesto de la cadena, que tiene el grupo alfa-carboxilo libre, es el extremo carboxiloterminal o C-terminalLa secuencia de aminoácidos de una proteína se escribe enumerando los aminoácidos desde el extremo N-terminal al C-terminal.
ver animación del enlace peptídico
Características del enlace peptídicoCaracterísticas del enlace peptídico. + corto. ~ doble enlace. C=O y N-H: mismo plano, distancias y ángulos fijos. No gira. Enlaces con el resto de ambos aá, pueden girar.
1) El enlace peptídico es un enlace covalente muy resistente, lo que hace posible el gran tamaño y estabilidad de las moléculas proteicas.
2) Los estudios de Rayos X de las proteínas han llevado a la conclusión de que el enlace C-N del enlace peptídico se comporta en cierto modo como un doble enlace y no es posible, por lo tanto, el giro libre alrededor de él.
3ª) Todos los átomos que están unidos al carbono y al nitrógeno del enlace peptídico mantienen unas distancias y ángulos característicos y están todos ellos en un mismo plano.
Los atomos que forman el enlace C-N se sitúan en un mismo plano, debido a la estabilidad por resonancia que se produce, lo que confiere al enlace un caracter parcial de doble enlace cuya rigidez no permite movimientos de rotación entre dichos átomos. En ese caso los electrones del enlace se mueven dentro de la molécula dando lugar a dos formas mesómeras.
El par de electrones libres del nitrógeno se deslocaliza en el carbonilo, formando un doble enlace parcial.
Sin embargo los enlaces que unen los otros atomos de carbono pertenecen a las cadenas laterales (R) y si que pueden girar. Otro aspecto a destacar es que las cadenas laterales se disponen alternativamente arriba y abajo.
ver animación de los aminoácidos y el enlace peptídico