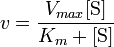ENZIMAS II
CINÉTICA DE LA ACTIVIDAD ENZIMÁTICA
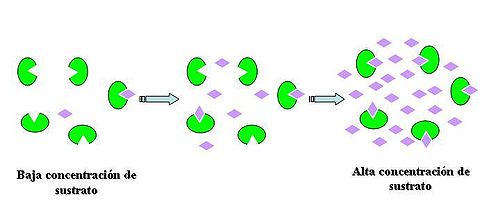
En una reacción enzimática con una concentración de enzima constante, si se incrementa la concentración del sustrato, se produce un aumento de la velocidad de reacción. Al haber más moléculas de sustrato, se aumenta la probabilidad de encuentro entre el sustrato y la enzima
La velocidad de la reacción será directamente proporcional a la concentración de sustrato activado:
v = k [S*]
No obstante, si se aumenta la concentración de sustrato, se llega a un punto en que la velocidad de reacción deja de aumentar. Esta velocidad se denomina velocidad máxima (Vmax)
Esta situación se debe a que todas las moléculas de la enzima ya están ocupadas por moléculas de sustrato. Esta situación se denomina saturación (de la enzima) por sustrato
La velocidad de la reacción va aumentando a medida que aumenta la concentración de sustrato hasta que la enzima se satura. Cuando la concentración de S es muy alta, todas las moléculas de enzima forman rapidamente complejos ES, y un aumento adicional de S no tiene efecto sobre la velocidad inicial. Las moléculas de S extra tendrán que esperar a que se libere el producto P y las enzimas queden libres para unirse a ellas.
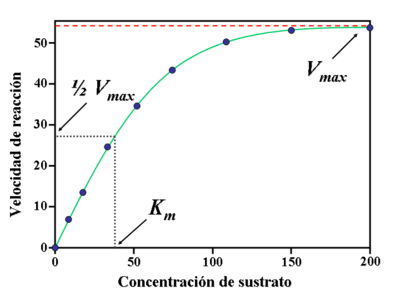
A partir de este comportamiento de las enzimas, Leonor Michaelis y Maud Menten definieron la constante de Michaelis-Menten (Km), que es la concentración del sustrato a la cual la velocidad de reacción es la mitad de la velocidad máxima. Esta constante depende del grado de afinidad existente entre el enzima y el sustrato.
Como las reacciones catalizadas por enzimas son saturables, la velocidad de catálisis no muestra un comportamiento lineal en una gráfica al aumentar la concentración de sustrato.
Representación gráfica de la curva de saturación de una enzima donde se puede observar como evoluciona la relación entre la concentración de sustrato
y la velocidad de la reacción.
La constante de Michaelis Km se define como la concentración a la que la velocidad de la reacción enzimática es la mitad de la Vmax
La siguiente ecuación permite calcular, a partir de la Vmax y la Km, la velocidad de reacción con diferentes concentraciones de sustrato.
ver animación cinética enzimática
FACTORES QUE AFECTAN A LA ACTIVIDAD ENZIMÁTICALas enzimas, como sustancias proteicas que son, van a ver condicionada su actuación por determinados factores físicos y químicos. Algunos de estos factores son:
La temperatura
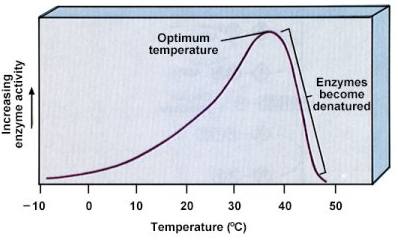
Como toda reacción química, las reacciones catalizadas enzimáticamente siguen la regla de Van't Hoff. Según la cual, por cada 10ºC, la velocidad de la reacción se duplica. Así, un aumento de energía calorífica hace que aumente la movilidad de las moléculas, y por tanto el número de encuentros moleculares.No obstante, las enzimas tienen una temperatura óptima para cada enzima, en la cual la actividad enzimática es máxima.
En el hombre, y en los animales homeotermos como el hombre, esta temperatura óptima coincide con la temperatura normal del organismo.Hay también que tener en cuenta que los enzimas, como proteínas que son, se desnaturalizan a elevadas temperaturas.
El pH
Los enzimas presentan un intervalo de ph en el que son activas. Sobrepasados los extremos de el intervalo, los enzimas se desnaturalizan como cualquier otra proteína y dejan de actuar. Entre ambos extremos, existe un ph óptimo, en el cual la enzima presenta la máxima eficacia.
El ph puede influir sobre las cargas eléctricas de los aminoácidos, y puede alterar la estructura del centro activo y, por lo tanto, también influirá sobre la actividad enzimática.
Los inhibidores
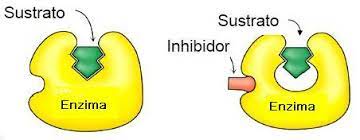
Determinadas sustancias van a poder actuar sobre las enzimas disminuyendo o impidiendo su actuación. Estas sustancias son los inhibidores. Se trata de moléculas que se unen a la enzima, impidiendo que ésta actúe sobre el substrato.Existen varios tipos de inhibición enzimática:
Algunos tipos de inhibición enzimática reversibles
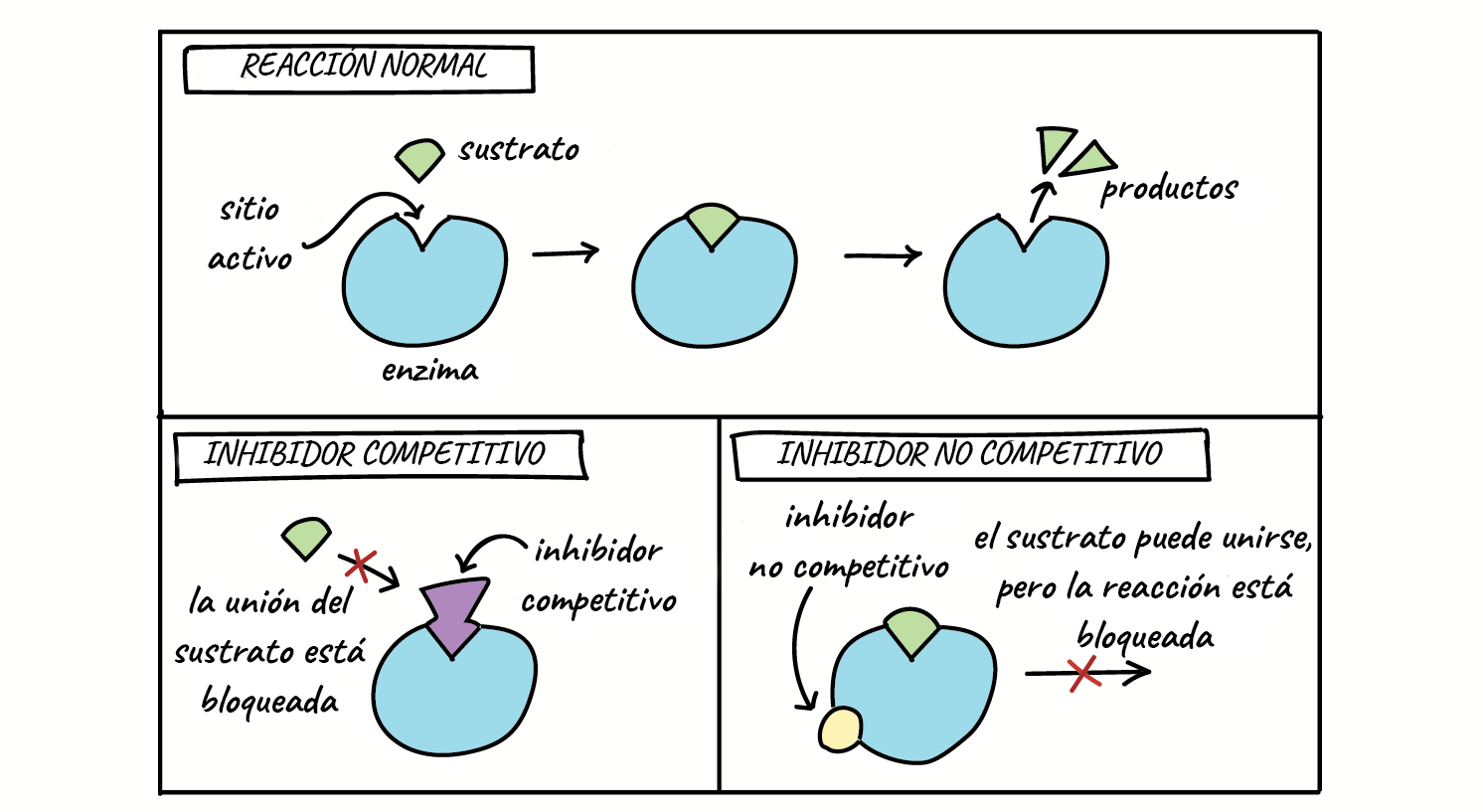
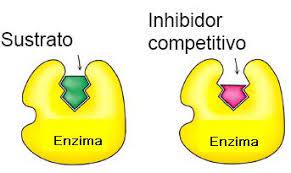
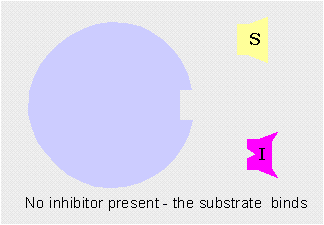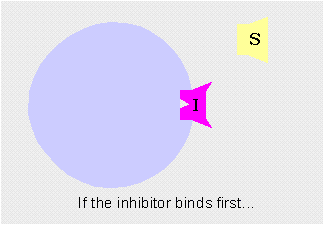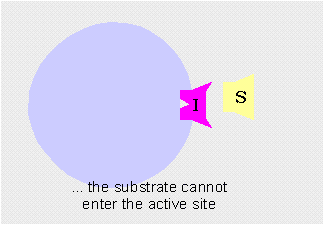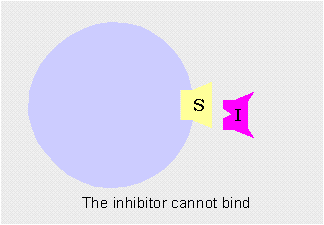
Inhibición competitivaCuando el inhibidor se une temporalmente al centro activo de la enzima impidiendo que el sustrato se una a él. Es reversible.
Se trata de una inhibición que depende de la concentración de sustrato y de inhibidor.
Los inhibidores competitivos se unen reversiblemente al enzima, evitando la unión del sustrato. Por otro lado, la unión del sustrato evita la unión del inhibidor. Así pues, sustrato e inhibidor compiten por la enzima.
Inhibición no competitivaCuando el inhibidor se une reversiblemente a un punto diferente del centro activo pero con su actuación lo modifica lo suficiente que, aunque se puedan unir la enzima y el sustrato, la catálisis no se produce o la velocidad de ésta disminuye.
Este tipo de inhibición no depende de la concentración de sustrato. La inhibición alostérica sería una inhibición no competitiva (ver modulación alostérica más adelante)
Inhibición no competitiva
A menudo, los inhibidores (irreversibles) suelen ser el propio producto de la reacción enzimática o el producto final de una cadena de reacciones (ver más adelante).
Inhibición irreversible o envenenadoraSon moléculas que se unen irreversiblemente al centro activo de la enzima impidiendo pernanentemente que esta actúe.
Inhibición irreversible
En el tratamiento de cáncer, algunos medicamentos que se emplean como quimioterapia, actúan como inhibidores enzimáticos irreversibles y pueden impedir la acción de ciertas enzimas que las células cancerosas necesitan para crecer, y que no afectan a las células sanas.
Ciertos antibióticos como la penicilina y la vancomicina inhiben a la enzima responsable de la producción y el entrecruzamiento de las hebras de peptidoglicano,? lo cual da lugar a una pérdida de fuerza de la pared celular y, por consiguiente, a la lisis de la bacteria.
Muchos tóxicos y venenos funionan como inhibidores irreversibles.
La toxina peptídica alfa-amanitina, encontrada en los hongos de la especie Amanita phalloides, es un potente inhibidor enzimático capaz de impedir la actividad de la ARN polimerasa II en la transcripción del ADN
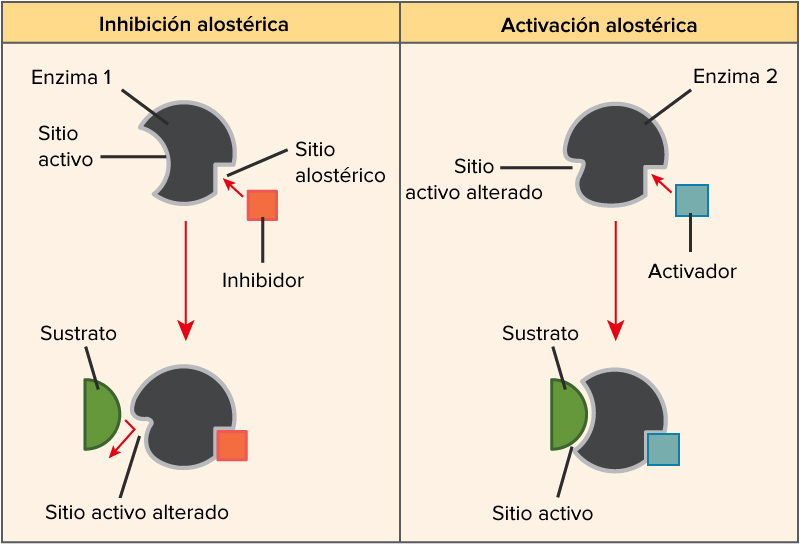
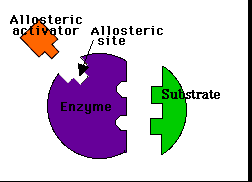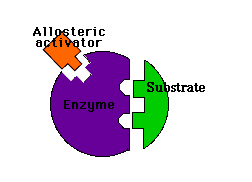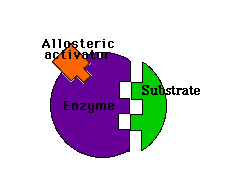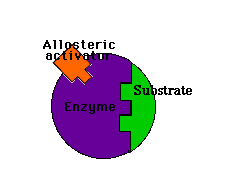
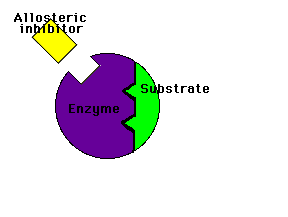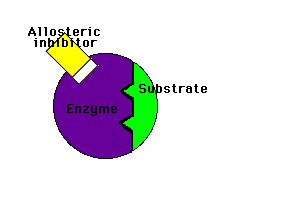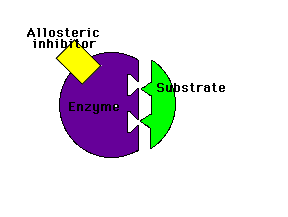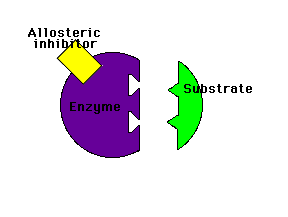
Modulación (regulación) alostérica de la actividad enzimáticaLos enzimas alostéricos son aquellos que, además del centro activo mediante el cual interactúan con el sustrato, poseen otro centro de unión llamado centro alostérico mediante el cual interactúan con otra molécula denominada efector o modulador alostérico (la palabra "alostérico" hace referencia a la existencia de ese "otro lugar")
Así, estos enzimas pueden adoptar dos conformaciones interconvertibles llamadas R (relajada) y T (tensa).
R es la forma más activa porque se une al sustrato con más afinidad.
Las formas R y T se encuentran en equilibrio R <==> T
Los moduladores alostéricos pueden ser de dos tipos:
- unos estimulan la actividad del enzima al unirse al centro alostérico, y reciben el nombre de moduladores positivos o activadores
- otros la inhiben y se llaman moduladores negativos o inhibidores.
Modulación alostérica negativa y positiva en un enzima
Los llamados moduladores positivos tienden a estabilizar la forma R. Las moléculas que favorecen la forma R pero que actúan sobre una región del enzima distinta del centro activo son los activadores alostéricos.El propio sustrato es a menudo un modulador positivo.
Activador alostérico: favorece la unión del sustrato
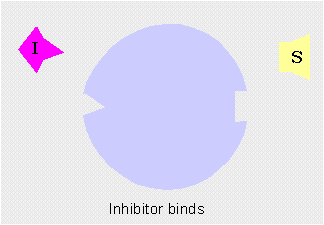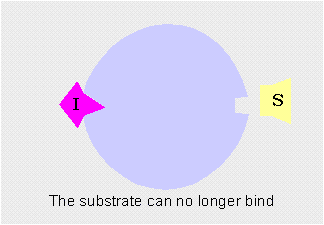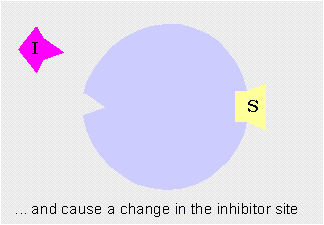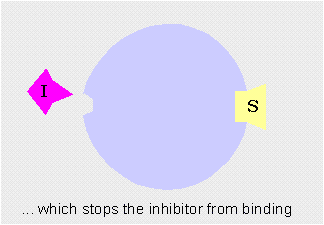
Los moduladores negativos son sustancias que favorecen la forma T y disminuyen la actividad enzimática. Si estos moduladores actúan en lugares distintos del centro activo del enzima se llaman inhibidores alostéricos
Inhibidor alostérico: impide la unión del sustrato
Es frecuente que los inhibidores (no irreversibles) sean el propio producto de la reacción enzimática o el producto final de una cadena de reacciones.
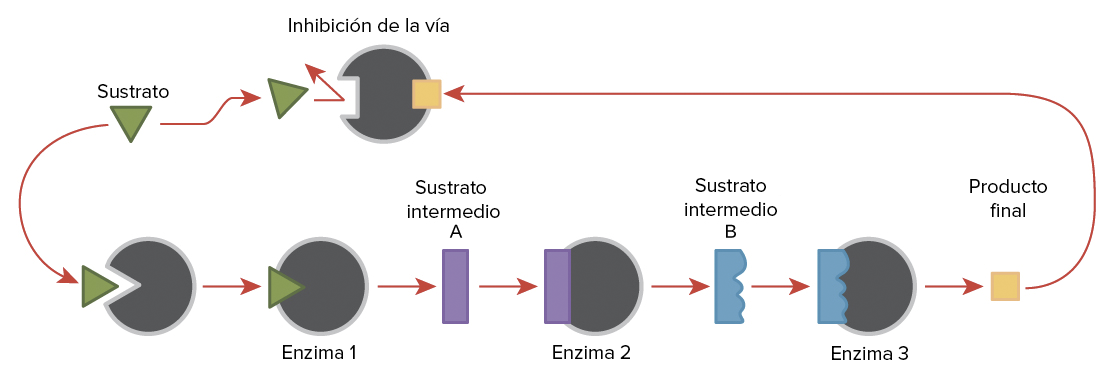
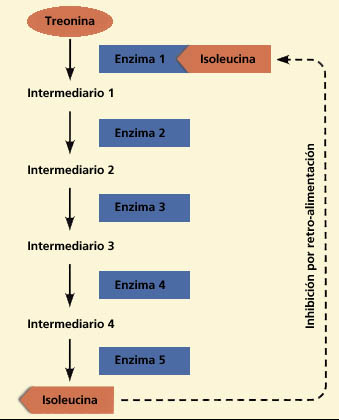
Un caso muy común de regulación del metabolismo mediante enzimas alostéricos es la inhibición por el producto final, también llamada retroinhibición o control feed-back y es una manera que tienen las enzimas de regular su actividad.
En ella, el producto final de una ruta metabólica inhibe alostéricamente al enzima que cataliza la primera reacción de dicha ruta, interrumpiendo así su propia síntesis cuando ésta ya no es necesaria.
Este tipo de control es muy rentable para la célula, ya que no se interrumpe solamente la síntesis del producto final sino la de todos los intermediarios. Se trata de un control mediante un modulador negativo.
Regulación de la actividad enzimática mediante retroalimentación (feedback)
Generalmente, el control de actividad de las enzimas es por encendido o apagado de las enzimas y está asociado con enzimas alostéricas Cuando los productos en una vía aumentan, ellos mismos producen feedback a la primera enzima de la vía y cierran la síntesis de los productos finales e intermedios.
ver animación inhibición alostérica (retroinhibición)
Otro caso de regulación de la actividad enzimática se produce cuando el sustrato de la primera reacción de una ruta metabólica actúa como activador del enzima que cataliza dicha reacción.
MECANISMOS QUE AUMENTAN LA EFICACIA ENZIMÁTICA
- Existencia de rutas metabólicas -> reacciones encadenadas, es decir, el producto final de una reacción constituye el reactivo inicial de otra
Reacciones reversibles encadenadas
- Compartimentación celular: Distintas rutas en distintos compartimentos.
Localización de las principales rutas catabólicas en la célula
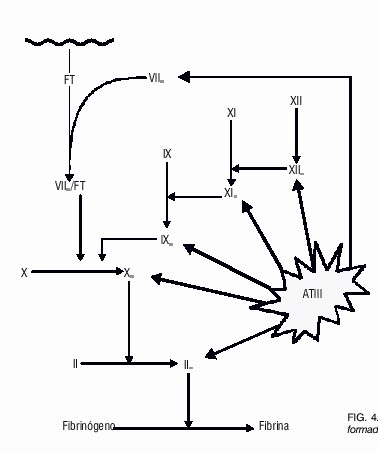
- Efecto "cascada": Sucesión de reacciones: Proenzima -> enzima activo, catalizadas por el enzima activo anterior hasta llegar a la reacción buscada: metabolito sustrato -> producto final (Coagulación sanguínea: Fibrinógeno -> fibrina).
Secuencia de reacciones que producen la coagulación de la sangre
Factor tisular: desencadenante. Ca y vit. K: cofactor, coenzima
Protrombina ->trombina. Trombina cataliza Fibrinógeno> fibrina.
- Complejos multienzimáticos: Partículas elementales F1: Complejo ATP sintasa. ATPsintasa
ATP sintasa
- Isozimas: Distintas moléculas enzimáticas para la misma reacción, pero con diferentes Km. Se localizan en diferentes orgánulos.
COFACTORES Y COENZIMASLa actividad enzimática puede resultar afectada no solo por factores físicos o químicos, sino también por la presencia de sustancias no proteínicas, por lo general, de baja masa molecular denominadas cofactores
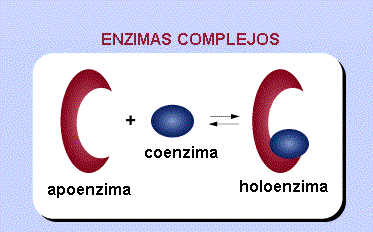
Si los cofactores son imprescindibles para la actividad enzimática, la enzima completa recibe el nombre de holoenzima y su parte proteínica (inactiva, sin el cofactor) el de apoenzima.
Un cofactor puede ser de naturaleza inorgánica u orgánica (algunas enzimas requieren ambos)
Cofactores inorgánicosSe trata de iones metálicos como Zn2+, Ca2+, Fe2+, Mg2+ que solo se precisan en cantidades diarias de miligramos o microgramos.
Algunos pueden actuar como grupos puente, uniéndose simultáneamente al sustrato y al centro activo de la enzima.
Otros pueden atraer electrones de un sustrato para cederlo a otra molécula.
Por útimo, algunos iones como el cobre o el hierro poseen de por si cierta actividad catalítica, la cual, resulta amplificada por la proteína.
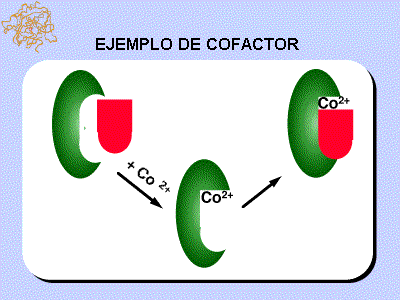
Ejemplo de cobalto como cofactor inorgánico de un enzima
Cofactores orgánicos u organometálicosSe conocen como coenzimas, aunque a veces se reserva este nombre para moléculas débilmente unidas a la apoenzima.
Si la unión es de tipo covalente (fuerte) se llaman grupos prostéticos.
Holoenzima
Holoenzima
La unión apoenzima-coenzima es temporal y similar a la unión sustrato-enzima, por lo que la coenzima puede considerarse como un segundo sustrato.
Por lo general, las coenzimas actúan como transportadores intermediarios de grupos funcionales, o de enzimas que catalizan reacciones de transferencia de electrones.
Cada clase de reacción tiene su particular coenzima, que se consume gracias a un conjunto de enzimas y se regenera por un conjunto distinto. No obstante, las coenzimas no suelen ser específicos de un solo tipo de enzima, y pueden unirse a muchos tipos distintos, con funciones diferentes.
Muchas coenzimas son vitaminas hidrosolubles o presentan vitaminas como constituyentes de su estructura.
Vitaminas: "aminas de la vida". Funk,1912. Beri-beri.
Indispensable con la dieta (exc: B5, K).
Pequeñas cantidades.
Precursoras de coenzimas, mol. activas.
Enfermedades carenciales: Avitaminosis, hipovitaminosis, hipervitaminosis.
Otros coenzimas no son vitaminas, como el ATP, el principal transportador de grupos fosfato.
La coenzima Q es atípica ya que transporta electrones y se difunde por el interior de una bicapa lipídica, es decir, no es hidrosoluble.
Coenzimas compuestos por vitaminas
Hidrosolubles: Precursoras o coenzimas: Complejo B y vit C.
Vit. B2 : Riboflavina>> FAD, FMN. Transferencia de H+. (Dermatitis)
Vit. B3 : Ac. Nicotínico>> NAD+,NADP+,Transferencia de H+ (Dermatitis, diarrea, demencia).
Vit. B5 : Ac. Pantoténico>> Coenzima A, Transferencia de grupos acilo.
Vit. C : Ac. ascórbico (Escorbuto).
Liposolubles: No coenzimáticas, (salvo K). Vit A, D, E, K
Vit. A: retinol (terpeno) rodopsina
Vit. K: Filoquinona (terpeno). Coagulación sanguínea.
Vit. E: tocoferoles. Antioxidante de ác.grasos. Esterilidad masculina.
Vit. D: Esteroles. Raquitismo.
Otros coenzimas
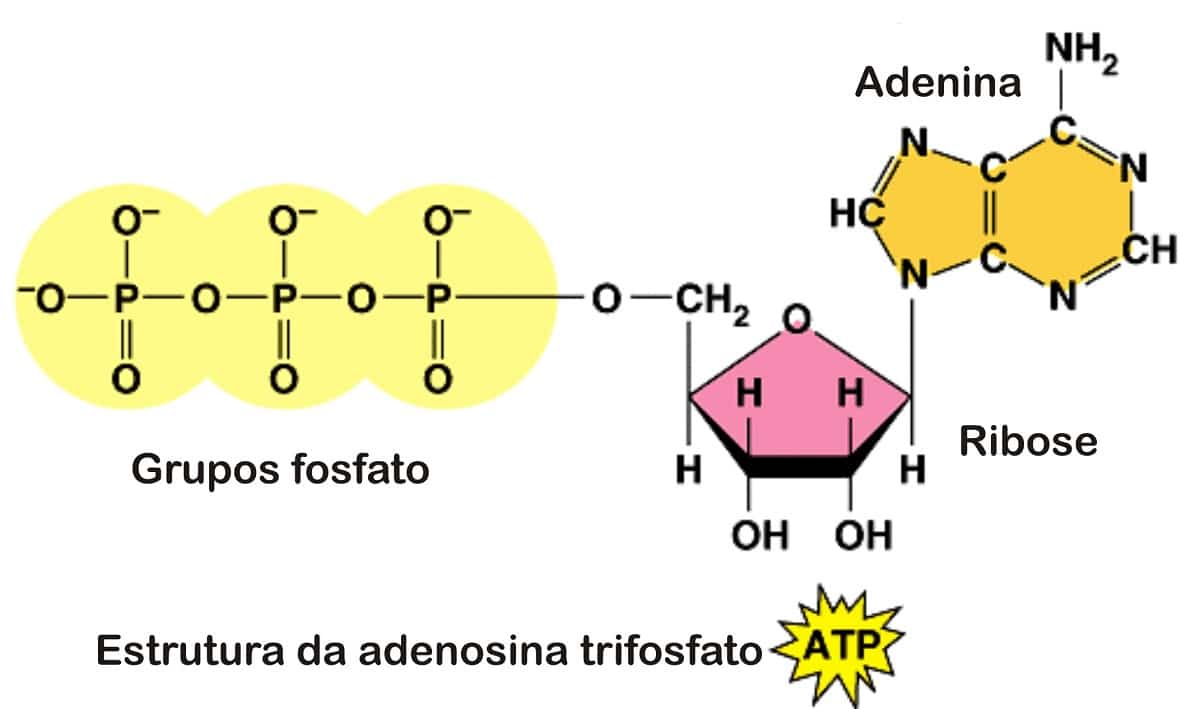
a) Coenzimas que intervienen en las reacciones en las que hay transferencias de energía:ATP (adenosina-5'-trifosfato): Adenina-Ribosa-P-P-P
ADP (adenosina-5'-difosfato): Adenina-Ribosa-P-P
El ATP y otras moléculas actúan transportando energía desde los procesos exergónicos a los endergónicos.
El ATP se puede transformar en ADP y Pi (fosfato inorgánico) al hidrolizarse el último de sus enlaces éster-fosfato, desprendiéndose más de 7 kcal por mol de ATP.
Por el contrario, en aquellas reacciones en las que se produce energía esta es acumulada al sintetizarse ATP a partir de ADP y fosfato inorgánico (Pi).
b) Coenzimas que intervienen en las reacciones en las que hay transferencias de electrones:
Muchos procesos químicos celulares de gran importancia: fotosíntesis, respiración celular, etc. son procesos de oxidación-reducción. Así, por ejemplo en la respiración celular, la glucosa se oxida al perder electrones, mientras que el oxígeno los capta reduciéndose.
Estos coenzimas actúan transportando estos electrones desde las sustancias que se oxidan a las que se reducen.
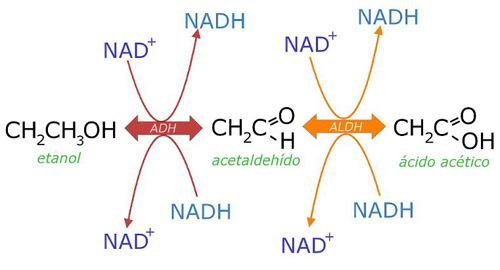
Coenzimas de nicotinamida: Derivan de la vitamina B3. Transfieren iones hidruro (H+) en las reacciones catalizadas por las oxidorreductasas llamadas deshidrogenasas.
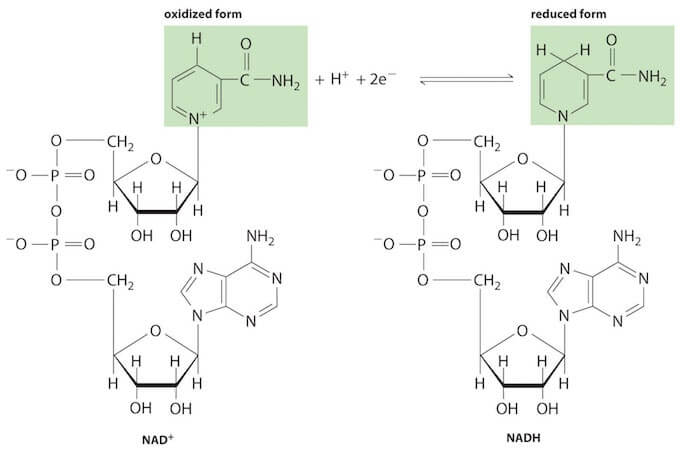
NAD+ (Nicotinamín adenín dinucleótido). Se trata de un dinucleótido formado por Nicotinamida-Ribosa-P-P-Ribosa-Adenina.
Así, por ejemplo, el NAD+ es capaz de captar dos electrones, y dos protones (H+), reduciéndose y transformándose en NADH+H+. Mientras que el NADH+H+ puede ceder estos dos electrones allí donde se necesiten para reducir a un compuesto químico, transformándose de nuevo en NAD+.
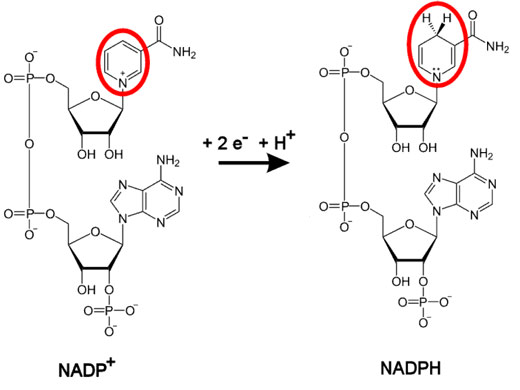
NADP+ (Nicotinamín adenín dinucleótido fosfato). Similar NAD+ pero con un grupo fosfato más esterificando el OH- del carbono 2 de la ribosa unida a la adenina.
Coenzimas de flavina: derivados de la vitamina B2, actúan como grupos prostéticos de las flavoproteínas, un tipo de oxidorreductasas que transfieren un par de átomos de hidrógeno.
FAD (Flavín adenín dinucleótido). Similar al NAD pero conteniendo riboflavina en lugar de nicotinamida.
FMN (mononucleótido de flavina)
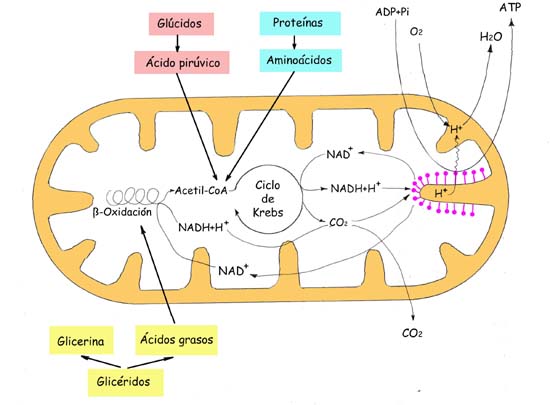
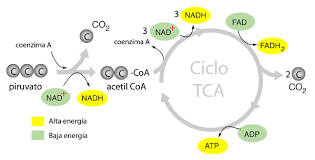
Participación de diferentes coenzimas
en el catabolismo de glúcidos
c) Coenzimas que intervienen como transportadores de grupos funcionales.
Pirofosfato de tiamina. Deriva de la vitamina B1. Actúa como un transportador de grupos aldehido cargados negativamente en reacciones de carboxilación.
Coenzima A (CoA). Coenzima de estructura compleja y de la que forma parte el ácido pantoténico (otra de las vitaminas del complejo B2). Transporta grupos acilo.
Fosfato de piridoxal. Es la forma activa de la vitamina B6 y es un grupo prostético de enzimas cono las transaminasas, que transfieren grupos amino.
Biotina. Esta vitamina B7 se encuentra unida covalentemente a una carbooxilasa, enzima que cataliza reacciones de transferencia de grupos carboxilo (carboxilato).
Tetrahidrofolato. Deriva de la vitamina B9. Transporta grupos formilo, metilo, metileno y otros que poseen un solo carbono.
Coenzima B12. Es la forma activa de la vitamina B12. Interviene en reacciones en las que se desplaza un átomo de hidrógeno desde un átomo de C a otro adyacente, intercambiándolo por un grupo alquilo, carboxilo, hidroxilo o amino.
Cofactores no orgánicos:
Grupos prostéticos: unión fuerte, grupo hemino (catalasa). Una sola molécula proteica.
Cationes metálicos: Zn2+, Ca2+, Fe2+, Mg2+.
Cofactores orgánicos:Coenzimas: unión débil, dos moléculas diferentes.
(NAD+ ,NADP+ ,FMN+ ,FAD+ , CoA)
FAD NAD CoA
ver animación de repaso de enzimas