ENZIMAS I
EL CONTROL DEL METABOLISMO
Biocatalizadores y hormonasLas reacciones químicas que tienen lugar en las células son reguladas mediante un control bioquímico, que regula el tipo de reacciones y el momento en el que deben producirse. Esto se consigue mediante los biocatalizadores o enzimas, que son generalmente proteínas que posibilitan estas reacciones y regulan las vías metabólicas.
Enzima
En los organismos pluricelulares existe además otro tipo de control bioquímico que funciona a nivel de organismo, el denominado sistema hormonal o sistema endocrino. Las hormonas son unas sustancias segregadas por ciertas glándulas que actúan sobre determinadas células como mensajeros químicos, regulando su metabolismo.
Concepto de catálisis y papel de los catalizadores
La energía libre (G) es la energía que posee un sistema para poder realizar un trabajo y depende de la energía contenida en los enlaces químicos de las moléculas y del grado de desorden de dichas moléculas.
Una reacción exergónica es una reacción química donde la variación de la energía libre de Gibbs es negativa. Esto nos indica la dirección que la reacción seguirá. A temperatura y presión constantes una reacción exergónica se define con la condición: ΔG < 0; que describe una reacción química que libera energía en forma de calor, luz, etc.
Así, en una reacción exergonica, las sustancias químicas al reaccionar, desprenden energía calorífica. Este incremento de temperatura se debe a que la energía libre total de las sustancias reaccionantes (reactivos) es superior a la energía libre de las sustancias producidas (productos)
Sin embargo, y a pesar de que la energía libre de los reactivos es superior a la de los producos, la reacción no se produce espontáneamente. Primero es necesario suministrar la energía suficiente para debilitar los enlaces de los reactivos y posibilitar así su ruptura.
Es decir, aunque los productos de la reacción (P) posean una energía libre inferior a la de los reactantes o sustratos (S), muchas reacciones tienden a transcurrir con gran lentitud, aunque estén energéticamente favorecidas.
Ejemplos:
I) La descomposición del agua oxigenada (peróxido de hidrógeno) en agua y oxígeno, según la reacción:
2H2O2 → 2H2O + O2
es una reacción que puede transcurrir espontáneamente pero es extraordinariamente lenta. En condiciones normales se descomponen 100 000 moléculas cada 300 años por cada mol de H2O2 (6,023*10*23 moléculas).
II) La reacción de desfosforilación de la glucosa:
Glucosa-6P + H2O → Glucosa + Pi
es exergónica, pero se necesitan 292,6 kJ/mol para romper el enlace fosfoéster.
Esto se debe a que para que la reacción se desarrolle en cualquiera de los sentidos (S-›P o P-›S), es preciso alcanzar un estado intermedio, que requiere un aporte energético, denominado estado de transición en el que se puedan alinear grupos químicos, se formen cargas eléctricas, se reordenen enlaces y se lleven a cabo otros cambios que demandan una elevada energía de activación.
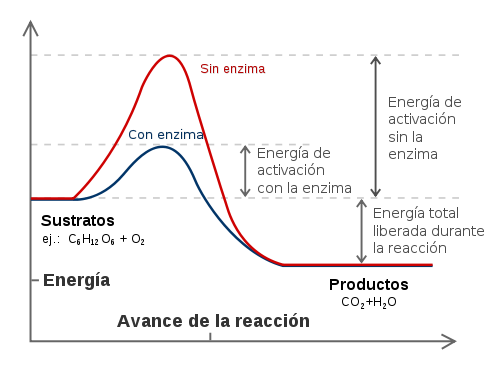
La energía expresada en calorías, necesaria para llevar un mol de moléculas de una sustancia hasta el estado de transición, a una determinada temperatura, se denomina energía de activación.
La velocidad de reacción puede incrementarse de dos maneras:
- Aumentando la temperatura, es decir, aumentando la energía cinética media de las moléculas (su energía térmica). Este método eleva la fracción de moléculas cuya energía excede a la de activación. En el caso de los seres vivos, este método es poco práctico ya que las células operan a temperatura constante o con pequeñas variaciones.
- Buscando caminos de reacción alternativos con menor energía de activación. Este método depende de moléculas conocidas como catalizadores que rebajan la altura del estado de transición y permiten que puedan acceder a él muchas moléculas que tienen poca energía.
Los catalizadores aumentan la velocidad de reacción sin consumirse en el proceso y sin alterar el balance final de energía libre de la reacción.
Si una reacción no es espontánea sin catalizador,
tampoco lo será con él.
El éxito de los seres vivos se puede atribuir a la capacidad de la célula para fabricar miles de catalizadores distintos, cada uno específico de determinada reacción química. En su mayoría tienen naturaleza proteica y se conocen como enzimas (también existen ribozimas: ARN catalítico)
Así, las enzimas son generalmente proteínas o asociaciones de proteínas y otras moléculas orgánicas o inorgánicas que actúan catalizando los procesos químicos que se producen en los seres vivos, actúan facilitando las transformaciones químicas acelerando considerablemente las reacciones y rebajando la energía de activación que muchas reacciones requieren.
En la primera de las reacciones descritas arriba,
la descomposición del agua oxigenada (peróxido de hidrógeno) en agua y oxígeno, según la reacción:
2H2O2 → 2H2O + O2
en presencia de una enzima que hay en nuestras células, la catalasa, el proceso se desarrolla con extraordinaria rapidez (el burbujeo que se produce al echar agua oxigenada en una herida es debido a esto).
Cuanto mayor sea el salto energético que se debe producir para que el S alcance este estado transitorio que le permite transformarse en P –energía de activación– más lenta es la reacción. Cuanto más bajo sea el obstáculo, antes se superará.
Gráfica de las energías de las diferentes fases de una reacción química. Los sustratos precisan mucha energía para alcanzar el estado de transición, pero una vez alcanzado, se transforman en productos. La enzima estabiliza el estado de transición, reduciendo la energía necesaria para formar los productos.
ver animación energía de activación
ver animación energía de activación (2)
ENZIMAS
Las enzimas son biocatalizadores, moléculas de naturaleza proteica que catalizan reacciones químicas, siempre que sea termodinámicamente posible (si bien pueden hacer que el proceso sea más termodinámicamente favorable).
En estas reacciones, las enzimas actúan sobre unas moléculas denominadas sustratos, las cuales se convierten en moléculas diferentes denominadas productos.
Características de las enzimas- Todas las enzimas, excepto las ribozimas (ARN con capacidad catalítica), son proteínas globulares.
- Pueden actuar a nivel intracelular, es decir, en el interior de las células o a nivel extracelular, tras ser segregadas por las células, como sucede con los enzimas digestivos.
- Las enzimas, como catalizadores que son, aceleran la reacción, no modifican la constante de equilibrio y tampoco se transforman, recuperándose intactas al final del proceso. La rapidez de actuación de las enzimas y el hecho de que se recuperen intactas para poder actuar de nuevo es la razón de que se necesiten en pequeñísimas cantidades.
- Sin embargo, se diferencian de los catalizadores no biológicos en su alta especificidad (generalmente actúan en una sola reacción), actúan a temperatura del ser vivo, poseen una alta actividad (mucho más rápidas que los catalizadores no biológicos) y poseen una masa molecular muy elevada
- Las enzimas no son activas hasta que no actúan sobre ellas otras enzimas o iones y normalmente se encuentran en forma de proenzimas.
Un ejemplo, el pepsinógeno es inactivo hasta que el clorhídrico del estómago lo transforma en pepsina (enzima activo).
CLASIFICACIÓN DE LAS ENZIMAS
Nomenclatura
Tradicionalmente: Sustrato - asa. Sacarasa, lipasa, etc.
Actualmente: Código de la Enzyme Comission.
EC 4.1.1.1: Piruvato descarboxilasa
4 -> Liasa
1-> C - C
1-> Grupo carboxilo
1-> Piruvato descarboxilasa.
Enzyme Comission
Clasificación
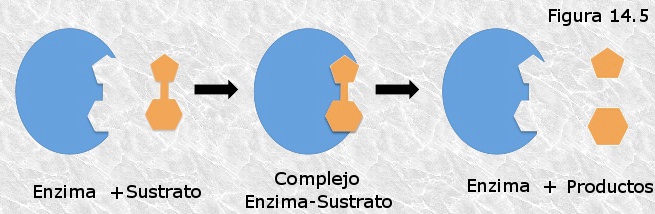
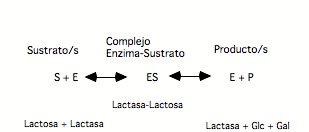
ACTIVIDAD ENZIMÁTICALa sustancia sobre la cuál actúa un enzima se denomina sustrato (S). La enzima y el sustrato se unen mediante enlaces débiles, formando el complejo enzima-sustrato (ES) que presenta los enlaces internos del sustrato debilitados.
Después se forma el complejo activado, que es el estado de transición del complejo enzima-sustrato. Para alcanzar este estado se requiere mucha menos energía que para llegar al estado de transición del sustrato solo.
Al acabar la transformación se convierte en complejo enzima-producto (EP), y finalmente el producto o productos (P) se desprende/n de la enzima.
Esquema acción enzimática
Estas tres etapas son reversibles, puede haber moléculas que se transformen en P, moléculas de P que se transformen en S, e incluso moléculas de S o P que se unan y liberen al enzima sin sufrir cambio alguno.
El que predomine una reacción u otra depende de las concentraciones de S o P que haga mínima la energía libre del sistema. La enzima simplemente acelera la consecución de dicho equilibrio.
Veamos algunos ejemplos:
Actuación de la enzima lactasa sobre la lactosa
Actuación de la enzima sacarasa sobre la sacarosa
Las enzimas tambien pueden actuar sobre varios sustratos y dar lugar a un solo producto (ejemplo: enzimas ligasas).
Una enzima (E) cataliza la reacción de dos sustratos (S1 y S2)
para formar un único producto (P).
ver animación acción enzimática
CENTRO ACTIVO DE LOS ENZIMASEn la cadena polipeptídica de una enzima (recordar que son proteínas) se distinguen tres tipos de aminoácidos:
- los aminoácidos estructurales (no establecen enlaces químicos con el sustrato)
- los aminoácidos de fijación (establecen enlaces químicos débiles con el sustrato)
- los aminoácidos catalizadores (establecen enlaces químicos débiles y fuertes con el sustrato).
Las reacciones enzimáticas tienen lugar en hendiduras de la superficie de los enzimas denominados centros activos.
Todas las enzimas poseen uno o más centros activos, que comprenden 3 o 4 aminoácidos que a veces se hallan muy separados en la estructura primaria.
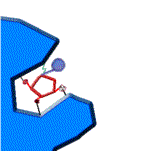
El punto clave de la acción de una enzima es la unión del sustrato (S) a los aminoácidos del centro activo, con lo que se forma el complejo enzima-sustrato (ES).
Tras producirse la reacción química se origina un complejo enzima-producto (EP) que finalmente libera el producto y deja la enzima libre para poder seguir actuando.
Fijación y catálisis de un sustrato en el centro activo de un enzima
Estos centros activos presentan las siguientes características:
- Constituyen una parte muy pequeña del volumen total del enzima
- Tienen una estructura tridimensional en forma de cavidad que facilita que el sustrato encaje y dificulta que lo haga otro tipo de moléculas.
- Están formados por aminoácidos que aunque se encuentran distantes en la estructura primaria del enzima, debido a los repliegues de la cadena, quedan próximos entre si.
- Existen dos tipos de aminoácidos en el centro activo que interaccionan con el sustrato:
Aminoácidos de fijación, que establecen enlaces débiles con el sustrato y se fijan a el
Aminoácidos catalizadores, que establecen enlaces débiles o fuertes (covalentes) con el sustrato y provocan la ruptura de alguno de sus enlaces. Estos son los responsables de su transformación en el producto o productos.
Centro activo de un enzima
ESPECIFICIDAD DE LAS ENZIMAS
Entre la enzima y el sustrato existe una alta especificidad. Solo se fijan a la enzima los sustratos que puedan establecer algún enlace con los aminoácidos fijadores. Y de estos, solo aquellos sustratos que presentan un enlace susceptible de ruptura próximo a los aa' catalizadores de las enzimas, podrán ser alterados.
Hay que destacar que las enzimas son específicas en más de un sentido.
- Una enzima puede actuar sobre un substrato o un grupo de substratos relacionados (especificidad de sustrato) pero no sobre otros; por ejemplo: la sacarasa, que hidroliza la sacarosa (los catalizadores inorgánicos pueden hacerlo con distintos tipos de sustratos).
- La enzima puede reconocer solo un grupo de moléculas (especificidad de grupo). Por ejemplo, la beta-glucosidasa actúa sobre todas las moléculas del grupo de los beta-glucosidos
- La actuación de un enzima puede depender del tipo de enlace y no del tipo de molécula (especificidad de clase). Por ejemplo, las enzimas fosfatasas separan los grupos fosfato de cualquier tipo de molécula.
- Únicamente tiene lugar una reacción química (especificidad de acción), sin que se produzcan reacciones laterales o subproductos. Es decir, el rendimiento de las reacciones enzimáticas es de un 100% (no se generan productos diferentes a los deseados).
Un catalizador artificial tiene un rendimiento del 90% (10 de cada 100 moléculas serán diferentes al producto esperado-deseado).
Modelos de unión del enzima con el sustrato
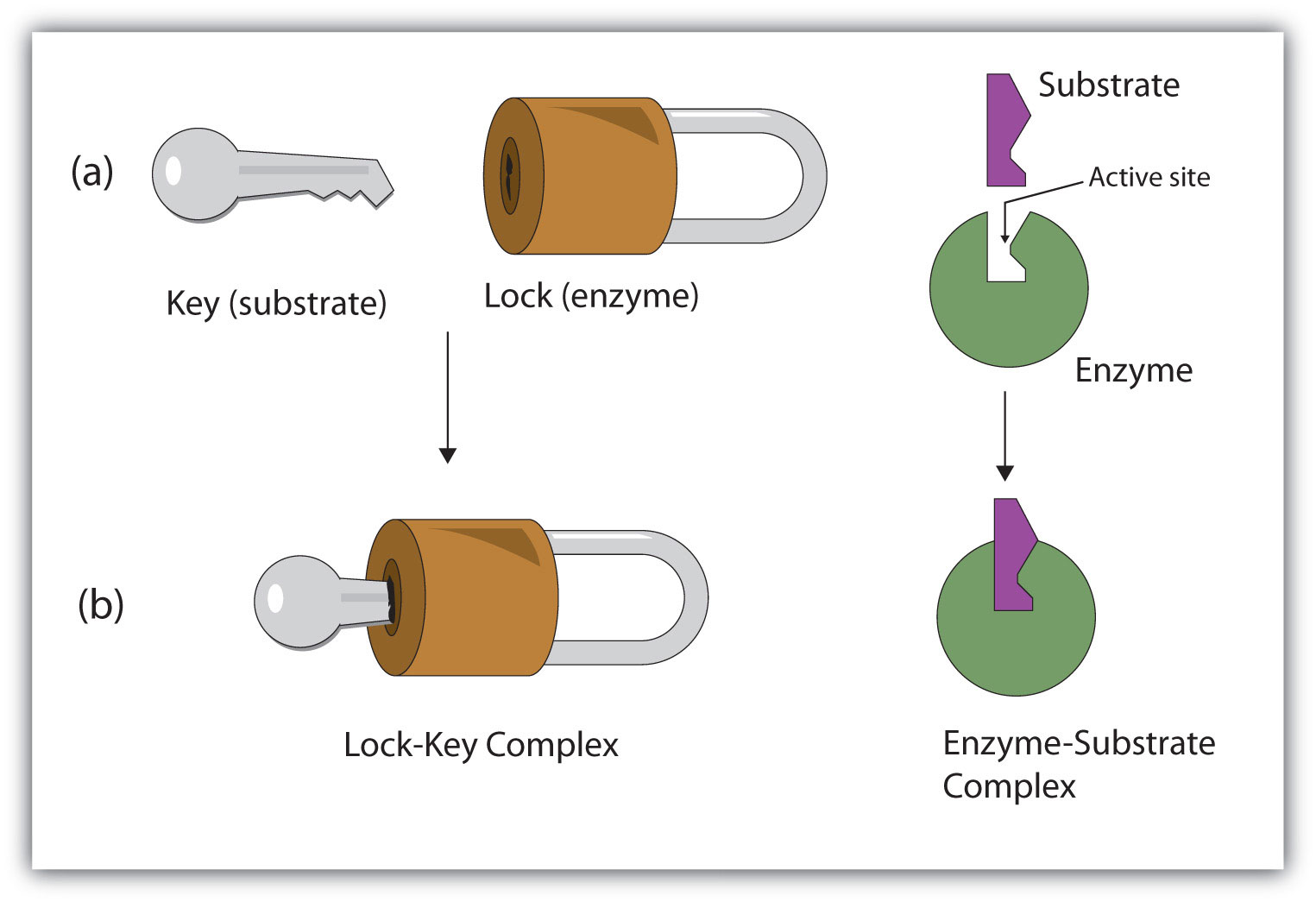
A) Modelo de llave y cerradura: La enzima es como una especie de cerradura molecular en que entran solo llaves moleculares en forma específica, o sea los sustratos.
Modelo de llave-cerradura
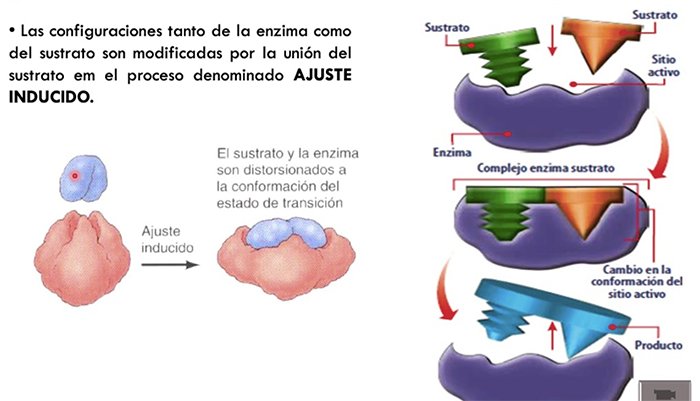
B) Modelo de ajuste o acoplamiento inducido (adaptación conformacional al sustrato): Cuando el sustrato se combina con la enzima induce un cambio en la forma de esta, que es posible porque los sitios activos de la enzimas son flexibles. Es el modelo aceptado actualmente.
Modelo de ajuste inducido
Debido a esta especificidad de las enzimas, existen en la célula miles de enzimas diferentes.