GLUCIDOS I
También llamados azúcares porque algunos poseen sabor dulce, son biomoléculas orgánicas formadas por C, H y O.
Tradicionalmente se llamaban hidratos de carbono o carbohidratos, ya que los primeros azúcares analizados tenían la fórmula Cn (H2O)n, lo que sugería que eran combinaciones de C y agua en proporción 1:1 Sin embargo, esto no es así. No son átomos de carbono hidratados o enlazados a moléculas de agua sino cadenas de carbonos unidos a otros grupos funcionales. Pueden presentar grupos aminos, fosfatos, sulfatos..., por lo que también pueden tener S, P y N
Desde el punto de vista químico, los glúcidos pueden definirse como polihidroxialdehidos y polihidroxiacetonas.
FUNCIONES EN LOS SERES VIVOS
Energética. Constituye el material energético de uso inmediato para los seres vivos; entre ellos, la glucosa es el azúcar más utilizado para este fin. Su oxidación libera energía que nos permite la realización de los procesos vitales.De reserva. Actúan como material de reserva energética, como ocurre con el almidón (vegetales) y el glucógeno (animales). Cuando las células lo necesitan, movilizan estas reservas, liberando moléculas de glucosa.
Estructurales. Algunos azúcares forman parte esencial de las paredes celulares de los vegetales (celulosa, pectina, hemicelulosa), de las paredes bacterianas (peptidoglicanos), del exoesqueleto de los artrópodos, de los caparazones de los crustáceos (quitina) y de los ácidos nucleicos (ribosa y desoxirribosa)
CLASIFICACIÓN DE LOS GLÚCIDOS
MONOSACARIDOS (Cn H2n On)
Propiedades
Son cristalizables, sólidos ♦ De color blanco. ♦ Sabor dulce. ♦ Solubles en agua. ♦ Con poder reductor, debido a la presencia del grupo aldehído o cetona. ♦ No son hidrolizables. ♦ Presentan actividad óptica. ♦ Isomería.
Nomenclatura
Según el número de carbonos: triosas, tetrosas, pentosas, hexosas y heptosas
Según el tipo de grupo carbonilo: aldosas y cetosas
Formas de representación
La isomería en los monosacáridos
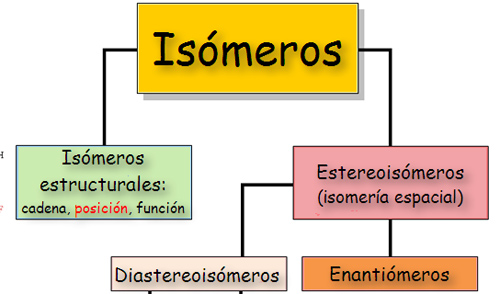
Cuando dos o más compuestos presentan la misma fórmula molecular o empírica y distintas fórmulas estructurales, se dice que cada uno de ellos es isómero de los demás.
La isomería es una característica que aparece en aquellas moléculas que tienen la misma fórmula empírica, pero presentan características físicas o químicas que las hacen diferentes. A estas moléculas se las denomina isómeros. En los monosacáridos podemos encontrar isomería de función, isomería espacial e isomería óptica.
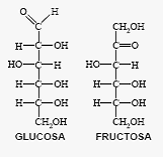
* Isomería de función Los isómeros se distinguen por tener distintos grupos funcionales. Las aldosas son isómeros de las cetosas.
Isomería de función. La glucosa es un isómero de la fructosa
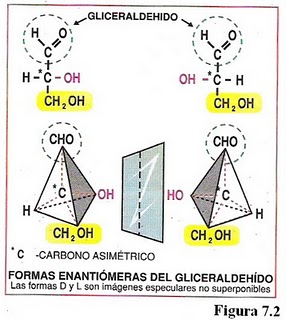
* Isomería espacial Los isómeros espaciales, o estereoisómeros, se producen cuando la molécula presenta uno o más carbonos asimétricos. Los radicales unidos a estos carbonos pueden disponerse en el espacio en distintas posiciones.
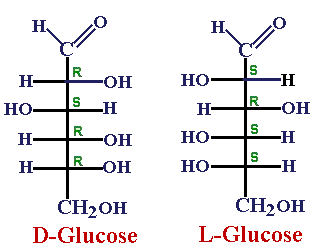
Todos los monosacáridos excepto la dihidroxiacetona poseen carbonos asimétricos o quirales. Estos carbonos se caracterizan por estar unidos a cuatro radicales diferentes.Por ejemplo el GHA que posee un carbono asimétrico puede dar lugar a dos isómeros que difieren en la posición espacial de sus radicales (-OH). Esto da lugar a la existencia de dos isómeros espaciales o estereoisómeros: el D-GHA (con el OH a la derecha) y el L-GHA (con el OH a la izquierda). Es decir misma fórmula pero diferente forma en el espacio
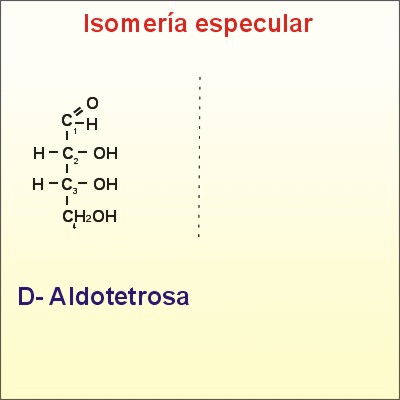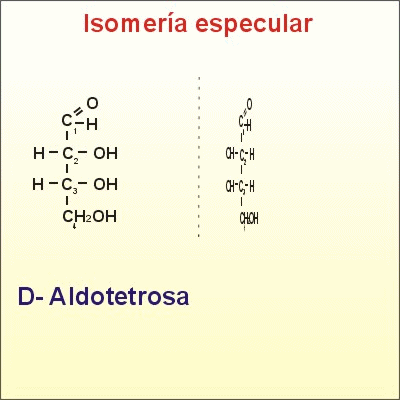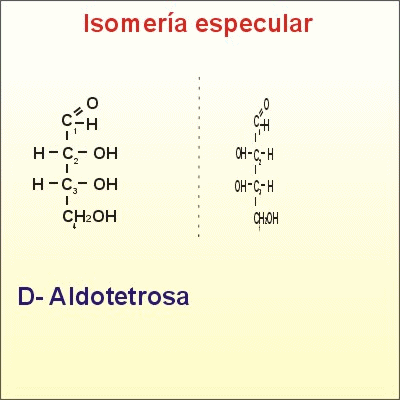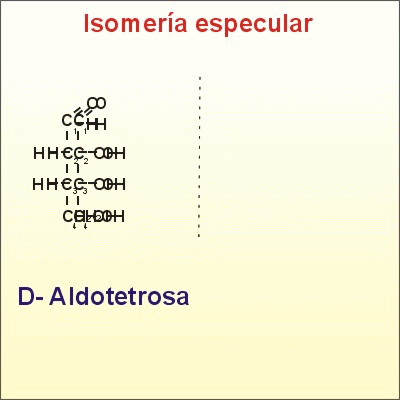
El número de isómeros posibles es 2(n), siendo n el número de carbonos asimétricos. Cuantos más carbonos asimétricos tenga la molécula, más tipos de isomería se presentan. Se pueden distinguir varios tipos de isómeros espaciales o estereoisómeros:* Cuando dos isómeros ópticos son imágenes especulares entre sí, es decir, si la imagen especular de uno no puede ser superpuesta con la del otro, se dice que son enantiómeros o enantiomorfos. Es el caso de la D-eritrosa y L-eritrosa.
Isómeros espaciales o estereoisómeros y además enantiómeros
Enantiómeros
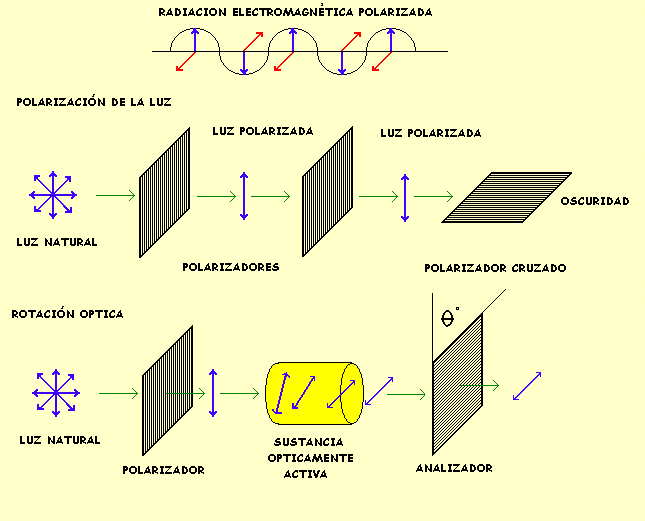
Los enantiómeros tienen las mismas propiedades físicas y químicas, excepto por la interacción con el plano de la luz polarizada o con otras moléculas quirales. La mezcla en cantidades equimolares de cada enantiómero en una solución se denomina mezcla racémica y es ópticamente inactiva.
* Cuando dos isómeros difieren en más de un átomo de carbono pero no son imágenes especulares entre sí (enantiómeros) se dice que son diastereoisómeros. Es el caso de La D-Alosa y la D-Altrosa.
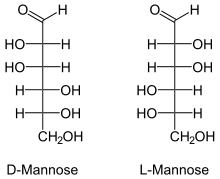
* Cuando dos isómeros ópticos difieren en la configuración de un único átomo de carbono, se dice que son epímeros. Los epímeros serían un tipo de diasteroisómeros. La D-glucosa, la D-galactosa y la D-manosa son epímeros porque sólo difieren en la configuración del carbono 4.
Epímeros
Ejercicio tipos de estereoisómeros
Por convenio se habla de dos formas en los monosacáridos;
• la forma D que incluye a aquellas osas cuyo penúltimo carbono (el más alejado del grupo carbonilo) tiene el grupo OH situado a la derecha. La mayoría de los azúcares que podemos encontrar en la naturaleza pertenecen a esta forma, la forma D. Esta fue la forma que se seleccionó en la evolución química y además tiene su importancia a la hora de entender la actividad enzimática ya que estos son estereoespecíficos, es decir que si fueran de otra manera no serían reconocidos.
• Así del mismo modo, la forma L es la imagen especular no superponible del isómero con estructura D
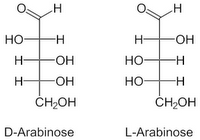
Arabinosa en sus formas D y L
Manosa en sus formas D y L
* Isomería óptica Este tipo de isomería se basa en la capacidad de estos azúcares de desviar la luz polarizada. Cuando se hace incidir un plano de luz polarizada (la que vibra en un solo plano) sobre una disolución de monosacáridos que poseen carbonos asimétricos el plano de luz se desvía. Si la desviación se produce hacia la derecha se dice que la molécula isómera es dextrógira y se representa con el signo (+). Si la desviación es hacia la izquierda se dice que la molécula es levógira y se representa con el signo (-).
No existe ninguna relación entre la estructura D ó L y que la molécula sea dextrogira o levógira.
Por ejemplo la D-Fructosa es levógira.
ver aldosas y cetosas
ver aldosas y cetosas (2)
Estructura de los monosacáridos
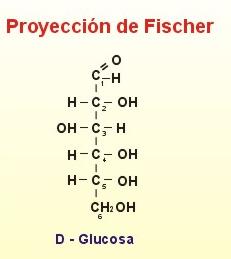
Ya hemos visto las estructuras en forma de cadena abierta (fórmulas de proyección de Fisher) de la glucosa (aldohexosa) y Fructosa (cetohexosa), dos de los azúcares más comunes en la naturaleza. Primero hay que numerar los carbonos: 1, 2, 3, 4.....
Numeración de los carbonos
Sin embargo cuando se estudió el comportamiento de estos azúcares se comprobó que sus reacciones químicas no se correspondían con las que cabía esperar suponiendo que su estructura fuera en forma de cadena abierta.1) Se encontró que el grupo aldehido actuaba de forma relativamente estable frente a sustancias con las que reaccionaba con facilidad (poder reductor). Esto sugería la existencia de una forma cíclica que de alguna manera enmascaraba la reactividad de este grupo.
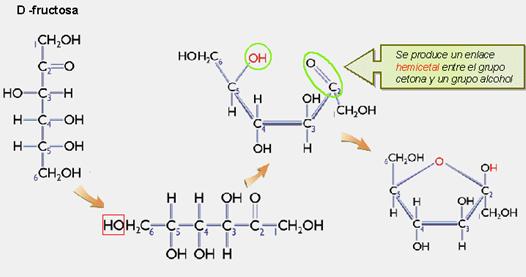
2) Se apreciaba un cambio en el poder rotatorio de las moléculas de glucosa desde que se inicia la disolución hasta que se alcanza el estado de equilibrio. A este fenómeno se le denomina mutarrotación. Esto sólo puede explicarse bajo la aparición de un nuevo carbono asimétrico en las moléculas de glucosa, lo que puede explicarse aceptando la forma cíclica.Así, en realidad lo que sucede es que los monosacáridos de 5 o más carbonos cuando se encuentra en disolución acuosa, no son formas lineales, sino que adoptan una estructura cíclica. Por ejemplo, en la glucosa reacciona el grupo aldehido con el grupo hidroxilo del quinto carbono dando lugar a un enlace hemiacetal intramolecular, de modo que el ciclo se cierra con un puente de oxígeno. El anillo resultante se denomina forma piranosa debido a su semejanza con el pirano
Ciclación de la glucosa (aldosa)
vídeo sobre ciclación de la glucosa
ver animación de la ciclación de la glucosa
ver vídeo de la ciclación de la D-Manosa
Del mismo modo en la fructosa, el grupo cetónico, situado en el segundo carbono, reacciona con el grupo hidroxilo del quinto carbono para formar un enlace hemicetál intramolecular. Este anillo de 5 componentes se denomina forma furanosa, también por su parecido con el furano
Ciclación de la fructosa (cetosa)
ver vídeo de la ciclación de la D-ribosa
Aldehido + Alcohol = Enlace hemiacetálico
Cetona + Alcohol = Enlace hemicetálico
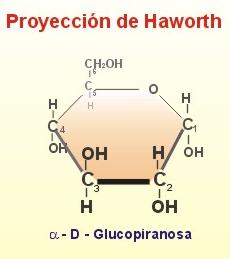
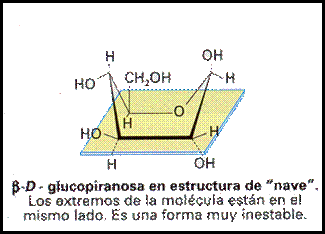
Como las longitudes de los enlaces no se corresponden exactamente con estas representaciones, Haworth propuso unas formulas planas, en las que los anillos se ven en perspectiva. Así, en esta representación se sitúan hacia abajo todos los grupos situados a la derecha en la fórmula lineal y hacia arriba los situados a la izquierda en la fórmula lineal, si exeptuamos al grupo -OH implicado en la formación del puente de oxigeno que sufre una rotación. En realidad estos anillos no son planos sino que adoptan dos configuraciones, la forma cis o de nave y la forma trans o de silla de montar.
Proyecciones de Haworth
Esta estructura cíclica permite hablar de dos nuevos estereoisómeros que se denominan anómeros (carbonos anoméricos), la alfa-D-glucopiranosa en la que el grupo -OH del primer carbono está situado hacia abajo (trans) en la proyección de Haworth, y la beta-D-glucopiranosa, en la que se sitúa hacia arriba (cis).
Ciclación de la glucosa en sus dos formas alfa y beta; y ciclación de la fructosa en sus formas alfa y beta
Poder reductor de los monosacáridos
Hay que destacar que todos los monosacáridos sin excepción, poseen poder reductor, es decir, gracias a la presencia de un grupo carbonilo libre (aldehido o cetona). El grupo carbonilo se oxida con facilidad a un ácido carboxílico, desprendiéndose elctrones que pueden ser captados por otra sustancia que esté presente en el medio que se reducirá.
Esta es la base para poder reconocerlos en el laboratorio. Es decir, dan POSITIVO en la Prueba de Fehling (prueba colorimétrica, cualitativa), prueba bioquímica de identificación de los azúcares reductores.
El glúcido se oxida al reaccionar con el reactivo de Fehling pasando a Acido ómico y el oxido cuprico (o de cobre II) del reactivo, se reduce a oxido cuproso (cobre I) de color rojo ladrillo. Es decir aprovecha el fundamento de toda reacción de oxidación-reducción que uno se oxida y el otro se reduce.
Solución de fehling + Monosacárido (reductor) = Precipitado ROJO
Oxido de Cobre II AZUL de Oxido de Cobre I
Cuando las cantidades de azucar son muy pequeñas para detectarlo mediante Fehling, se realiza la Prueba de Benedict
Monosacáridos de interés biológico
Triosas: Gliceraldehido y Dihidroxiacetona. Lineales. Ésteres fosfóricos intermediarios metabolismo glucídico.
Tetrosas: Lineales. Eritrosa. Metabolismo glucídico.
Pentosas: Aldofuranosas, lineales las cetosas. Ribosa.Nucleótidos: ATP, ARN. Desoxirribosa (Pierde -OH en C2): ADN. L-Arabinosa: Goma arábiga, de cerezo. Ribulosa: Cetosas. Fijación del CO2 en la fotosíntesis.
Hexosas: Aldopiranosas, cetofuranosas. Glucosa: Azúcar de la uva, Lactosa, Reserva: Almidón. Glucógeno. Estructural: Celulosa. Combustible celular en la respiración. Galactosa: No suele encontrarse libre. Lactosa. Hemicelulosas. Galactosemia. Fructosa o levulosa: Azúcar de frutas. Sacarosa: azucar de caña o remolacha
Heptosas y Octosas. Poco frecuentes.
Derivados de los monosacáridos
Los derivados de los monosacáridos se originan mediante cambios químicos de estos a través de procesos de REDUCCION, SUSTITUCION, OXIDACION O ESTERIFICACIÓN
Por reducción de un grupo hidroxilo se obtienen los desoxiazúcares que pierden un grupo hidroxilo en alguno de los carbonos. Ejemplo, la Desoxirribosa que ha perdido su grupo alcohólico en el carbono 2.
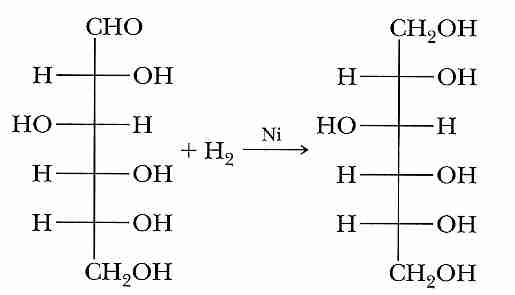
Por reducción del grupo carbonilo del carbono anomérico a grupo hidroxilo: el manitol, derivado de la manosa, el xilitol, derivado de la xilosa (en hongos y líquenes), el glicerol o glicerina, derivado del GHA, constituyente en muchos lípidos y el sorbitol, derivado de la glucosa, se encuentra en las frutas y puede producir cataratas por su acumulación en el cristalino.
Formación de sorbitol por reducción de la glucosa
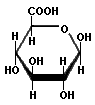
Por oxidación se forman los denominados ácidos urónicos como por ejemplo el ácido glucurónico que posee un grupo carboxilo en su carbono terminal. Otro es el ácido galacturónico.
Ácido glucurónico
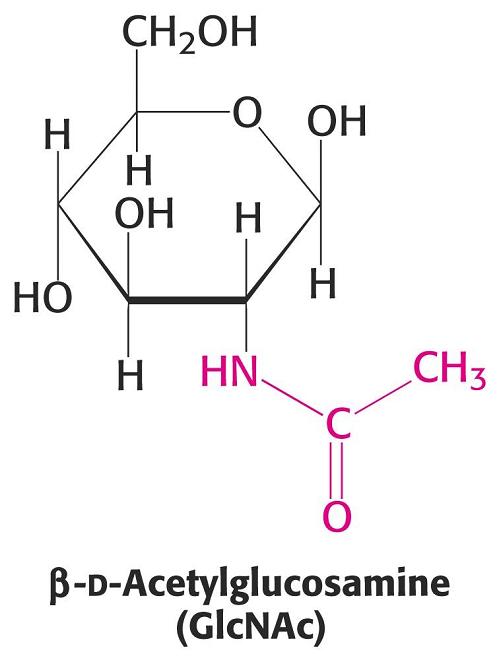
Por sustitución del grupo -OH del carbono 2 por un grupo amino, o por un grupo acetilamino (-NH-CO-CH3), se forman los aminoazúcares como la glucosamina, la N-Acetilglucosamina (NAG) (en el exoesqueleto de artrópodos y pared celular de hongos), la N-acetil D-galactosamina, que forma parte d elos cartílagos y el ácido N-acetil Murámico (NAM), que forma parte de los polisacáridos de las paredes celulares bacterianas.
N-acetilmurámico
Por reacción de los grupos -OH (alcohólico o hemiacetálico) con el ácido ortofosfórico dando lugar a los ésteres fosfóricos. Son intermediarios en las rutas del metabolismo. Por ejemplo, la glucosa-6 fosfato.
Formación de la glucosa 6P